微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达到一定的浓度遇明火即迅速爆炸,其原因是( )。
A.粉末状态的煤比块状煤的着火点低
B.粉末状态的煤比块状煤放出的热量多
C.粉末状态的煤比块状煤的总表面积大
D.粉末状态的煤呈气态,属于可燃性气体
参考答案:C
本题解析:煤变为粉末状态时,总表面积大,与空气中的氧气密切接触时,一旦遇见火源,便发生剧烈的氧化还原反应。
本题难度:一般
2、填空题 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________
________________________________________________________________________。
(2)要加快上述实验中气体产生的速率,还可采取的措施有______________________
__________________________________________________________________(答两种)。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4 mol/LH2SO4/mL
| 30
| V1
| V2
| V3
| V4
| V5
|
饱和CuSO4溶液/mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O/mL
| V7
| V8
| V9
| V10
| 10
| 0
|
其中:V1= ,V6 ,V9= 。
参考答案:(1)CuSO4+Zn=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑
(2) 升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种即可)
(3) 30 ; 10 ; 17.5
本题解析:(1)锌能和硫酸铜溶液发生置换反应生成铜,从而构成铜锌原电池,加快反应速率,则有关氟方程式是CuSO4+Zn=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑。
(2)影响反应速率的因素还有温度、浓度以及表面积等,所以还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等。
(3)要探究外界条件对反应速率的影响,则只能是改变1个变量。根据表中数据可知,变化的是硫酸铜和水的体积,稀硫酸的体积使不变的,则V1=30ml。溶液的硫酸铜和水的体积之和是20ml,所以V6=20ml-10ml10ml,V9=20ml-2.5ml=17.5ml。
考点:考查外界条件对反应速率对影响的有关实验探究
点评:该题是中等难度的试题,侧重对学生实验探究能力的培养,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。也有助于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:一般
3、选择题 在一定体积的密闭容器中引发下列反应 C(S)+CO2(g)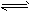 2CO(g) 能加快反应速率的是
2CO(g) 能加快反应速率的是
[? ]
A.增加碳的用量
B.加入氦气使容器内气压增大
C.再通入一定量CO2
D.想办法取出一定量的CO
参考答案:C
本题解析:
本题难度:一般
4、选择题 四氯化硅还原法是当前制备较高纯度硅的一种方法,有关反应的化学方程式为:
SiCl4 + 2H2 4HCl + Si, 下列说法不合理的是
4HCl + Si, 下列说法不合理的是
[? ]
A.反应制得的硅可用于制造半导体材料
B.增大压强有利于加快上述反应的化学反应速率
C.四氯化硅可以由粗硅与氯气通过化合反应制得
D.混入少量空气对上述反应无影响
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列实验事实不能用平衡移动原理解释的是( )
A.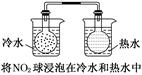
B.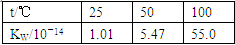
C.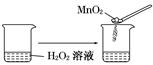
D.
参考答案:C
本题解析:本题考查化学平衡移动原理及化学反应速率的影响因素,意在考查考生对相关知识的掌握情况。选项A可以用温度变化来解释化学平衡的移动,A项正确;选项B说明离子积随着温度的升高而增大,即温度升高,水的电离平衡正向移动,B项正确;选项C是催化剂对化学反应速率的影响,与化学平衡无关,C项错误;选项D中浓度与溶液pH的关系说明浓度对NH3·H2O的电离平衡的影响,D项正确。
本题难度:一般