|
高考化学知识点整理《物质的组成》答题技巧(2017年最新版)(四)
2017-08-06 09:17:35
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
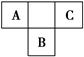
(1)写出A、B、C三元素名称______、______、______。
(2)C在元素周期表中的位置是_____________________________________。
(3)B的原子结构示意图为________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径:A________C,写出A的气态氢
化物与A的最高价氧化物对应水化物反应的化学方程式:___________________________。
参考答案:(1)氮 硫 氟 (2)第2周期ⅦA族? (3) 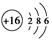 HF H2S HF H2S
(4)> NH3+HNO3===NH4NO3
本题解析:据A、B、C在周期表中的位置可知,A、C处于第二周期,B处于第三周期,设B的原子序数为x,则A为x-9,C为x-7,据题意有x-9+x-7=x,则x=16,又由于B原子核内质子数和中子数相等,则B的中子数为16,即为S,那么A为N,C为F。
本题难度:一般
2、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
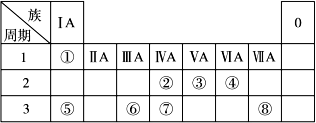
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。

(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是(?)
A.最高正化合价为+6价,
B.气态氢化物比H2S稳定,
C.最高价氧化物的水化物的酸性比硫酸弱,
D.单质在常温下可与氢气化合。
| (5) 已知X为ⅡA族元素(第一到第七周期),其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b与a所有可能的关系式___________________________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
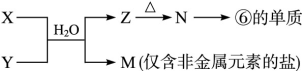
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
参考答案:(1)第三周期,第ⅣA族?(2分)
(2)分子晶体?(2分)、?原子晶体?(2分)
(3)? (2分)、 (2分)、  ?(2分)? B?(2分) ?(2分)? B?(2分)
(4)? BD?(2分)
(5) b=a+1?b=a+11? b=a+25?(写对一个1分,二个2分,全对4分)。
(6)Al3++3NH3·H2O=Al(OH)3↓+3NH4+?(2分)
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子(其它合理答案给分)(2分)
本题解析:由题意可知①为H ②为C ③为N ④为O ⑤为Na ⑥为Al ⑦为Si ⑧为Cl,②的最高价氧化物为CO2,可形成分子晶体⑦的最高价氧化物为SiO2,可形成原子晶体。① 、④、 ⑤中的元素可形成的含离子键和共价键的离子化合物有NaOH、Na2O2. ①和④形成的化合物为H2O.由题意可知W为Se,与S同主族,但是非金属性比S弱,所以在常温下难与氢气化合且气态氢化物的稳定性比H2S弱,(5) 当X、Y同在二、三周期时b=a+1 、当X、Y同在四、五周期时b=a+11、当X、Y同在六、七周期时b="a+25" 。⑹突破口在于“Z→N→⑥的单质”。确定Z为Al(OH)3,M为仅含非金属元素的盐,所以为铵盐,确定X、Y为可溶性的铝盐和氨水。
本题难度:一般
3、选择题 实验是化学研究的基础。下列关于各实验装置的叙述正确的是

A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置③可用于收集H2、CO2、Cl2、NH3等气体
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
参考答案:C
本题解析:试题分析:选项A、分离互不相溶的液体混合物应用分液装置,装置①为蒸馏装置,故错误。
选项B、防止倒吸应使水处于上层,因此应用CCl4溶液。
选项C、正确。选项D、碱石灰的主要成分为CaO和NaOH,均能与氯化氢反应,故不能用碱石灰干燥。综上,答案为C。
考点:化学实验与装置
点评:本题是对化学实验装置的考查,是高考必考内容,属于中等难度的题型。同时也体现了实验在化学学习中的重要性。解题关键在于掌握课本中常见的实验装置以及物质之间的性质与反应。
本题难度:一般
4、填空题 X是一种重要的工业原料, X在160℃分解制备异氰酸和氨气,反应方程式为:X  ?HCNO + NH3(已配平)。完成下列填空: ?HCNO + NH3(已配平)。完成下列填空:
(1)在上述反应所涉及的各元素中,原子半径最大的元素是_________,其原子核外电子共占据_______个轨道。
(2)在上述物质中有三种元素处于同周期,下列叙述中能说明三种元素C,N,O非金属性递变规律的事实是____________。
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) 2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=__________mol/L·min。
(4)当该反应达到平衡时,下列说法一定错误的是___________。
a.气体密度不变? b.气体颜色不变
c.υ(NO)正= 2υ(N2)逆? d.N2和NH3的浓度相等
(5)X可以代替NH3还原烟气中的NOx,X的分子模型如图所示,X电子式为______________。

(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出氰酸和异氰酸的结构式:_______________、______________。
参考答案:(1)C(1分),4个(1分)
(2)c(2分)
(3)0.005mol/(L·min)?(2分)
(4)c(2分)
(5)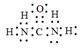 (2分) (2分)
(6) 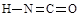 (2分) (2分)
本题解析:根据X  ?HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。 ?HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。
(1)各元素中,原子半径最大的元素是碳,其原子核外电子共占据4个轨道分别是1S22S22P2,其中S轨道2个,P轨道2个。
(2)元素非金属性递变规律的事实可能通过c.两两形成化合物中元素的化合价来判断,由于氧元素没最高价氧化物对应水化物,故也无法通过单质与H2反应的难易程度来判断。正确答案为bc。2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) 2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=0.4/(2*20)*2="_0.005mol/(L·min)" 。
(4)a.气体密度始终不变,不能做为判断依据。b.气体颜色不变即浓度不变,正确。c.υ(NO)正= 2υ(N2)逆比值关系错误,错误。d.N2和NH3的浓度相等不一定平衡,正确。故选C。
(5)X电子式为 。 。
(6)根据信息氰酸和异氰酸的结构式 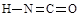 。 。
本题难度:一般
5、选择题 能说明一定是金属元素的事实是(? )
A.原子最外层只有1个电子的元素
B.在化学反应中能失去电子的原子
C.在化合物中只有正价没有负价的元素
D.能跟非金属反应的物质
参考答案:C
本题解析:A不正确,例如氢元素最外层电子数是1个;B不正确,例如碳元素等能失去电子;金属元素只能失去电子,只有正价,而没有负价,C正确;D不正确,氧气也能和非金属反应,答案选C。
点评:该题的解题思路是通过举例、逐一排除筛选得到正确的答案。
本题难度:一般
| 