微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 s轨道和p轨道杂化的类型不可能有
A.sp杂化
B.sp2杂化
C.sp3杂化
D.sp4杂化
参考答案:D
本题解析:试题分析:由于p能级含有3个轨道,所以s轨道和p轨道杂化的类型可以是sp1杂化,sp2杂化,Sp3杂化,但不可能是sp4杂化,答案选D。
考点:考查杂化轨道类型的判断
点评:该题是基础性试题的考查,也是高考中的常见考点,主要是考查学生对杂化轨道类型含义以及形成条件的了解掌握情况,旨在培养学生的逻辑推理能力,提高学生的学习效率。
本题难度:困难
2、选择题 配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物?[Cu(H2O)4](OH)2的中心离子、配体、中心离子的电荷数和配位数
A.Cu2+、H2O、+2、4
B.Cu+、H2O、+1、4
C.Cu2+、OH-、+2、2
D.Cu2+、H2O、+2、2
参考答案:A
本题解析:考查配位键的形成与有关判断。根据化学式可知,水分子提供孤对电子,所以水是配体,配位数是4;铜离子接受孤对电子,属于中心离子,因此正确的答案选A。
本题难度:困难
3、选择题 A元素的阳离子、B元素的的阴离子都具有相同的电子层结构。则A、B元素原子序数大小是
A.B<A?
B.A<B?
C.B="A?" ?
D.A=B+1
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列离子方程式中,正确的是
A.稀硫酸滴在铁片上:2Fe+6H+=Fe3++3H2↑
B.氢氧化镁与稀盐酸反应:OH-+H+=H2O
C.碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
D.硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓
参考答案:C
本题解析:分析:A、铁和稀硫酸反应生成硫酸亚铁和氢气;
B、氢氧化镁是难溶于水的氢氧化物;
C、碳酸氢钠和盐酸反应生成氯化钠水和二氧化碳;
D、硫酸铜和氢氧化钡反应生成氢氧化铜沉淀和硫酸钡沉淀.
解答:A、铁和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为:Fe+2H+=Fe2++H2↑,故A错误;
B、氢氧化镁是难溶于水的氢氧化物;离子方程式为:Mg(OH)2+2H+=2H2O+Mg2+,故B错误;
C、碳酸氢钠和盐酸反应生成氯化钠水和二氧化碳的离子反应为HCO3-+H+=H2O+CO2↑,故C正确;
D、硫酸铜和氢氧化钡反应生成氢氧化铜沉淀和硫酸钡沉淀;反应的离子方程式为:Ba2++SO42-+Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故D错误;
故选C.
点评:本题考查了离子方程式的书写方法和注意问题,物质溶解性,反应实质的判断是解题关键,题目难度中等.
本题难度:困难
5、选择题 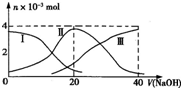 常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表
常温下,向20mL?0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表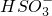 、Ⅲ代表
、Ⅲ代表 ).根据图示下列判断正确的是
).根据图示下列判断正确的是
A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-12?
B.当V(NaOH)=20?mL时:c(Na+)>c()>c(H+)>c()>c(OH-)
C.当V(NaOH)=40?mL时2c(Na+)=c()
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,溶液的温度会继续升高
参考答案:B
本题解析:分析:A.当V(NaOH)=0时,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=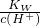 ;
;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,电离为主,溶液显酸性;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应.
解答:A.当V(NaOH)=0时,由图象可知,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=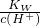 ≠1.0×10-12mol/L,故A错误;
≠1.0×10-12mol/L,故A错误;
B.当V(NaOH)=20?mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,HSO3-电离大于水解,溶液显酸性,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故B正确;
C.当V(NaOH)=40?mL时,由图象可知,溶质为Na2SO3,以水解为主,则c(Na+)>2c(SO32-),故C错误;
D.当V(NaOH)=40?mL后,继续滴加NaOH溶液,不再发生化学反应,所以温度变化不明显,不会继续升高,故D错误;
故选B.
点评:本题考查离子反应,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图中分析即可,不需要进行计算,题目难度中等.
本题难度:困难