微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某同学想用实验证明FeCl3溶液显黄色不是氯离子造成的,下列实验无意义的是
A.观察KCl溶液没有颜色
B.向FeCl3溶液中滴加适量NaOH溶液,振荡静置,过滤后所得滤液黄色消失
C.向FeCl3溶液中滴加适量AgNO3溶液,振荡静置,过滤后所得滤液黄色未消失
D.加水稀释后FeCl3溶液黄色变浅
参考答案:D
本题解析:氯化钾溶液中存在的离子有:钾离子、氯离子、水分子,可以与氯化铁溶液中的离子分析比较,得出显色的是铁离子,故A正确,氯化铁与氢氧化钠反应生成了氢氧化铁沉淀和氯化钠,将铁离子转化成了沉淀,只有氯离子和水分子留下来了,得出显色的是铁离子,故B正确,加入硝酸银后将氯离子转化为沉淀,但溶液的黄色未消失,可以得出显色的不是氯离子而是铁离子,故C正确,加水后改变了氯化铁溶液的浓度,而对离子不会造成消除,故D错误。所以选D。
本题难度:一般
2、填空题 (14分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
(1)该浓盐酸中HCl的物质的量浓度为__________mol/L。
(2)配制250mL 0.1mol/L的盐酸溶液?
应量取浓盐酸体积/mL
| 应选用容量瓶的规格/mL
|
?
| ?
|
A.用量筒量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入蒸馏水,用玻璃棒慢慢搅动,使其混合均匀。
B.将已冷却的盐酸沿玻璃棒注入容量瓶中。
C.用蒸馏水洗涤?2—3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm 处,改用?加水,使溶液凹面恰好与刻度相切。
处,改用?加水,使溶液凹面恰好与刻度相切。
E.将容量瓶盖紧,振荡,摇 匀。
匀。
(3) 若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水?;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度?;
③定容时俯视容量瓶刻度线?。
(4)实验室里迅速制备少量氯气可利用以下反应:2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O 此反应不需要加热,常温下就可以迅速进行。
①用“双线桥法” 标明电 子转移的方向和数目:
子转移的方向和数目:
2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
②用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为?mol,需要KMnO4的质量 ?g
参考答案:(1)? 12mol/L? (2分)?
(2)2.1 ?(2分) ?250 (1分)?烧杯(1分)?胶头滴管 (1分)
(3)①无影响? (1分)?②偏小 (1分)?③偏大 (1分)
(4) ①(2分)
得到10e-

2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O

失去10e-
②? 0.05 mol(1分)? 3.16g(1分)
本题解析:略
本题难度:一般
3、选择题 根据下列实验操作和现象所得出的结论不正确的是
选项
| ?实验操作
| ?实验现象
| ?结论
|
A
| 向等浓度且较稀的NaCl、KI混合
液中滴加AgNO3溶液
| ?先出现黄色沉淀
| Ksp(AgCl)>Ksp(AgI)
|
B
| 向溶液x中滴加浓NaOH溶液,
将湿润红色石蕊试纸置于试管口
| ?试纸变蓝
| ?原溶液中有NH4+
|
C
| 溴乙烷与NaOH溶液共热后,加入
AgNO3溶液
| 未出现淡黄色沉淀
| ?溴乙烷没有发生水解
|
D
| 将SO2通入溴水中
| ?溴水褪色
| ? SO2具有还原性
参考答案:C
本题解析:A、向等浓度且较稀的NaCl、KI混合液中滴加AgNO3溶液,先出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI),正确;B、向溶液x中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,原溶液中有NH4+,正确;C、溴乙烷与NaOH溶液共热后,加入AgNO3溶液?未出现淡黄色沉淀,原因是未加稀硝酸中和过量的氢氧化钠溶液,错误;D、将SO2通入溴水中,溴水褪色,说明SO2具有还原性,正确。
本题难度:简单
4、实验题 (12分)碱式碳酸镁[一般以xMgCO3?yMg(OH)2?zH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图:
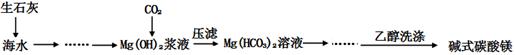
(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是:?。
②氢氧化镁浆液与CO2反应的化学方程式为:
?。
③碱式碳酸镁用乙醇洗涤的目的是:?。
(2)已知:碱式碳酸镁分解反应方程式为:
xMgCO3?yMg(OH)2?zH2O  (x+y)MgO+xCO2↑+(y+z)H2O (x+y)MgO+xCO2↑+(y+z)H2O
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g。根据实验测定的数据,确定碱式碳酸镁[xMgCO3·yMg(OH)2?zH2O]的化学式(要求写出计算过程)。
参考答案:(1)①作燃料、提供能量?(2分)
② Mg(OH)2+2CO2 = Mg(HCO3)2?(2分)
③除去表面杂质、减少固体的损耗?(2分)
(2)由题意得:
n(Mg2+)=20.0g/40g·mol-1=0.5mol?(1分)
n(CO2)=17.6g/44g·mol-1= 0.4mol?(1分)
据元素守恒得:
m(MgCO3)=0.4mol×84g·mol-1=33.6g(1分)
m[Mg(OH)2]=(0.5mol-0.4mol)=5.8g(1分)
n(H2O)=44.6g-33.6g-5.8g/18g·mol-1=0.4mol(1分)
x:y:z=4:1:4
则碱式碳酸镁的化学式为:4MgCO3·Mg(OH)2·4H2O(1分)(其它过程合理也给分)
本题解析:(1)①CaCO3高温分解生成CaO和CO2,所以焦炭的作用是:作燃料、提供能量。
②根据流程图,CO2与Mg(OH)2反应后的产物经压滤得到Mg(HCO3)2,所以CO2与Mg(OH)2反应的化学方程式为:Mg(OH)2+2CO2 = Mg(HCO3)2
③因为碱式碳酸镁在水中引起轻微的碱性反应,不溶于乙醇,所以用乙醇洗涤可以除去表面杂质、减少固体的损耗。
(2)残留固体为CaO,碱石灰吸收CO2,质量增加量为CO2的质量,可得:
n(Mg2+)=20.0g/40g·mol-1=0.5mol?(1分)
n(CO2)=17.6g/44g·mol-1= 0.4mol?(1分)
据元素守恒得:
m(MgCO3)=0.4mol×84g·mol-1=33.6g(1分)
m[Mg(OH)2]=(0.5mol-0.4mol)=5.8g(1分)
n(H2O)=44.6g-33.6g-5.8g/18g·mol-1=0.4mol(1分)
x:y:z=4:1:4
则碱式碳酸镁的化学式为:4MgCO3·Mg(OH)2·4H2O(1分)
本题难度:一般
5、选择题 为验证淀粉水解可生成还原性糖进行了下列实验,该实验中操作步骤的排列顺序正确的是( ? )
①取少量淀粉加水制成悬浊液? ②加热煮沸
③加入新制的Cu(OH)2悬浊液? ④加几滴稀硫酸
⑤再加热直至沸腾? ⑥加入碱液,中和直至溶液呈碱性
A.①②④⑤③⑥
B.①④②③⑤⑥
C.①④②⑥③⑤
D.①⑤③④⑥②
参考答案:C
本题解析:淀粉水解的实验的步骤为:取少量纯淀粉加适量水配成溶液;在淀粉溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;由于水解完毕生成还原性糖葡萄糖,与新制Cu(OH)2悬浊液发生氧化反应,须在碱性条件下,所以,在冷却后的溶液中先加入NaOH溶液调pH至碱性,然后再加入新制Cu(OH)2悬浊液溶液,水浴加热,其实验结果有砖红色沉淀产生。所以该实验中操作步骤的排列正确顺序为:①④②⑥③⑤,答案选C。
点评:该题紧扣教材基础知识,主要是考查了淀粉水解,以及新制Cu(OH)2悬浊液试剂与葡萄糖发生氧化反应的条件,注意该操作的前后顺序,题目较简单,有利于培养学生的逻辑思维能力和规范严谨的实验设计能力。
本题难度:简单
|