微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分子X、Y、Z,Y有刺激性气味,Z常温下为液态,元素E的单质的水溶液有漂白性.
请回答下列问题:
(1)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是______;
(2)在锅炉水中加入C2A4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,C2A4?被氧化,且反应中无污染物生成,写出反应的化学方程式(不必配平)______,1mol?C2A4?参加反应转移电子的数目为______,氧化产物的化学式为______;
(3)化合物Y与元素C的最高正价氧化物的水化物按物质的量比为2:1完全反应后的水溶液呈______?性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序为______;
(4)用X、D2和能传导O2-的固体电解质组成的原电池中,负极的电极反应式为______.
(5)A、B、D三种元素可以形成最简式为B2A4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂.则这种有香味的有机物在一定条件下水解的化学方程式是______.
参考答案:现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层,又知元素A能分别与元素B、C、D形成电子总数相等的化合物分子X、Y、Z,Y有刺激性气味,则A为氢元素;元素E的单质的水溶液有漂白性,则E为氯元素;Z为氢化物,Z常温下为液态,Z为水,所以D为氧元素;X、Y、Z电子总数相等,Y有刺激性气味,Z为水,分子含有10个电子,则Y为NH3,故C为氮元素,所以X为CH4,故B为碳元素.
故A为氢元素;B为碳元素,C为氮元素,D为氧元素;E为氯元素;X为CH4,Y为NH3,Z为水.
(1)元素E的单质为Cl2,在氯水中存在以下平衡Cl2+H2O?

?HCl+HClO,CaCO3与氯水中的HCl反应,使?c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强,
故答案为:元素E的单质为Cl2,在氯水中存在以下平衡Cl2+H2O?

?HCl+HClO,CaCO3与氯水中的HCl反应,使?c(H+)减小,平衡向右移动,HClO浓度增大,故漂白性增强;
(2)C2A4为N2H4,在锅炉水中加入N2H4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,N2H4?被氧化,且反应中无污染物生成,N2H4被氧化为氮气,同时生成水,反应的化学方程式为6Fe2O3+N2H4=4Fe3O4+N2↑+2H2O,氧化产物是N2;氮元素化合价由-2价升高为0价,1mol?N2H4?参加反应转移电子的数目为1mol×4×NAmol-1=4NA,
故答案为:6Fe2O3+N2H4=4Fe3O4+N2↑+2H2O;4NA;N2;
(3)Y为NH3,与元素C的最高正价氧化物的水化物为HNO3,二者按物质的量比为2:1完全反应,氨气有剩余,溶液为氨水与硝酸铵1:1混合溶液,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,所以c?(NH4+)>c?(NO3-),c?(OH-)>c?(H+),一水合氨电离程度不大,所以溶液中离子浓度由大到小的顺序为c?(NH4+)>c?(NO3-)>c?(OH-)>c?(H+),故答案为:碱;c?(NH4+)>c?(NO3-)>c?(OH-)>c?(H+);
(4)用CH4、O2和能传导O2-的固体电解质组成的原电池中,负极发生氧化反应,甲烷在负极放电,在O2-环境下生成二氧化碳与水,负极的电极反应式为 CH4+4O2--8e-=CO2+2H2O,
故答案为:CH4+4O2--8e-=CO2+2H2O;
(5)A、B、D三种元素可以形成最简式为B2A4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂.所以有香味的有机物B2A4D为CH3COOCH2CH3,CH3COOCH2CH3在一定条件下水解的化学方程式是CH3COOCH2CH3+H2O催化剂
本题解析:
本题难度:一般
2、选择题 Na和Na+两种微粒中,不相同的是
[? ]
①核内质子数②核外电子数③最外层电子数④核外电子层数
A.①②
B.②③
C.③④
D.②③④
参考答案:D
本题解析:
本题难度:简单
3、简答题 A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题
(1)E、G两种元素的符号:E______、G______;F在元素周期表中的位置是______.
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是______.
(3)E在D2中燃烧生成化合物X中阴阳离子个数比为______;X中的阴离子电子式为______.
(4)能够说明可逆反应2CD2(g)

C2D4(g)达到平衡状态的标志是______;
①单位时间消耗2mol?CD2的同时,生成1mol?C2D4
②恒温恒压下,混合气体的密度不变
③CD2和C2D4的浓度之比为2:1
④混合气体的颜色不变
⑤单位时间消耗4mol?CD2的同时,消耗2mol?C2D4
(5)向含E的最高价氧化物的水化物0.5mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为______.
参考答案:A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,最高价氧化物对应水化物只有氢氧化铝能与酸、碱反应,故其中一种为氢氧化铝,另外为强酸与强碱,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为钠元素,F为铝元素,G为硫元素或氯元素;A与B、C、D可分别形成10电子分子,则A为氢元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2(1+11)=24,故D为氧元素,G为硫元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为氮元素.
故A为氢元素;B为碳元素,C为氮元素,D为氧元素,E为钠元素,F为铝元素,G为硫元素;
(1)由上述分析可知,E为Na;G为S;F为铝元素,原子核外有9个电子,有2个电子层,最外层电子数为7,处于周期表中第三周期第ⅢA族,
故答案为:Na;S;第三周期第ⅢA族;
(2)发生反应Zn+CuSO4═ZnSO4+Cu,形成铜锌-硫酸原电池,反应速率加快,
故答案为:发生反应Zn+CuSO4═ZnSO4+Cu,形成铜锌-硫酸原电池,反应速率加快;
(3)D为氧元素,E为钠元素,钠在氧气中燃烧,生成过氧化钠,过氧化钠中阴阳离子个数比为1:2;过氧根离子带2个单位的负电荷,氧原子之间形成1对共用电子对,电子式为
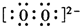
,故答案为:1:2;
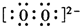
;
(4)①都表示正反应速率,反应自始至终都按该比例进行,不能说明到达平衡,故①错误;
②恒温恒压下,随反应进行混合气体的相对分子质量增大,密度不变,说明混合气体的平均相对分子质量不变,说明反应到达平衡,故②正确;
③反应到达平衡NO2与N2O4浓度之比可能为2:1,可能不是2:1,与开始的浓度及转化率有关,不能说明到达平衡,故③错误;
④、二氧化氮是红棕色,四氧化二氮无色,混合气体的颜色不变,说明二氧化氮的浓度不变,说明反应到达平衡,故④正确;
⑤单位时间消耗4mol?NO2的同时消耗2mol?N2O4,消耗4mol?NO2,生成2molN2O4,消耗与生成的N2O4的物质的量相等,说明反应到达平衡,故⑤正确.
故答案为:②④⑤;
(5)含0.5molNaOH的水溶液中通入标况下CO2气体11.2L,二氧化碳的物质的量为0.5mol,n(CO2):n(NaOH)=1:1,所以反应只生成碳酸氢钠,其化学反应方程式为NaOH+CO2=NaHCO3,故答案为:NaOH+CO2=NaHCO3.
本题解析:
本题难度:一般
4、简答题 已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小.则:
(1)A、B、C、D、E、F的名称分别是______.
(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式______,写出一种含非极性键的离子化合物的电子式______.
(3)由B和D组成,且B和D的质量比为3:8的化合物的电子式是______,该物质与E的同周期相邻主族元素的单质反应的化学方程式为______
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为______.
(5)将8g?BA4完全燃烧后恢复到室温,放出热量a?kJ,写出表示BA4的燃烧热的热化学方程式______.
参考答案:(3)A原子的电子层数与它的核外电子总数相同,应为H元素,B原子的最外层电子数是次外层的2倍,应为C元素,C的氢化物可使湿润的红色石蕊试纸变蓝,应为N元素,形成的氢化物为氨气,为碱性气体,B和D可以形成两种气态化合物,应分别为CO和CO2,则D为O元素,E原子核外电子总数比B的2倍v3,则E的原子序数为33,应为Na元素,A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增,且F在本周期元素中原子半径最小,应为Cl元素,
所以A、B、C、D、E、F的名称分别是氢、碳、氮、氧、钠、氯,
故答案为:氢、碳、氮、氧、钠、氯;
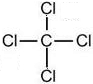
(2)在A至F中任选元素,含极性键的非极性分子有等CO2、CH4、CCl4,对应结构式分别为O=C=O、
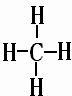
、
,含非极性键的离子化合物为Na2O2,电子式为
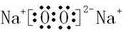
,
故答案为:O=C=O、
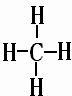
、

(任写两种);
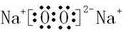
;
(3)由C和O组成,且C和O的质量比为3:个的化合物为CO2,电子式为

,与Na的同周期相邻主族元素为Mg,二者反应的化学方程式为CO2+2Mg?点燃?.?C+2MgO,
故答案为:

;CO2+2Mg?点燃?.?C+2MgO;
(4)Cl2与NaOH溶液反应生成NaClO和水,反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
(a)n(CH4)=个g36g/mol=个.amol,完全燃烧后恢复到室温,放出热量a?kJ,则3mol完全燃烧放出2akJ热量,所以表示CH4的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol.
本题解析:
本题难度:一般
5、简答题 U、W、X、Y、Z都是短周期元素,且原子序数依次增大.其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体.
请回答下列问题:
(1)Z元素在周期表中的位置______.W、X、Y、Z四种元素的原子半径由小到大的顺序是______(用元素符号表示).
(2)U与X形成的18电子化合物的电子式是______.
(3)ZX2与NaOH溶液反应的化学方程式是______.
(4)你认为U、W、X元素形成的化合物之间______(填“能”或“不能”)发生如下反应:WX+WU3→UWX2+U2X,得出此结论的理由是______.
(5)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是______,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共a?L(标准状况),则Y单质的质量是______g(用含a的代数式表示).
参考答案:U、W、X、Y、Z都是短周期元素,且原子序数依次增大.其中U与W可形成三角锥形分子A,则U为H,W为N,A为
NH3,U与X可形成常温下呈液态的分子B,A、B均为10电子分子,则X为O,B为H2O;Y元素原子的K层电子数与M层电子数相同,则Y为Mg;Z元素的单质、氧化物均为原子晶体,则Z为Si,
(1)Si的质子数为14,位于第三周期ⅣA族,原子的电子层数越多,半径越大,同周期元素从左向右原子半径在减小,则原子半径为O<N<Si<Mg,
故答案为:第三周期ⅣA族;O<N<Si<Mg;
(2)U与X形成的18电子化合物为H2O2,其电子式为
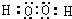
,故答案为:
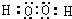
;
(3)SiO2与NaOH溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;?
(4)NO+NH3→HNO2+H2O中,只存在N元素的化合价升高,而不存在化合价降低的元素,即此反应关系中,只有失电子的物质,没有得电子的物质,则该反应不能发生,
故答案为:不能;在此反应关系中,只有失电子的物质,没有得电子的物质;
(5)Mg与二氧化碳的反应为2Mg+CO2??点燃?.??2MgO+C,C与浓硝酸反应生成二氧化碳和二氧化氮,设二氧化碳的物质的量x,
由电子守恒可知,x×4=(aL22.4L/mol-x)×1,解得x=a22.4×5mol,
再由2Mg+CO2??点燃?.??2MgO+C可知,Mg的物质的量为a22.4×5mol×2=2a22.4×5mol,
则Mg的质量为2a22.4×5mol×24g/mol=2×24a22.4×5=3a7,故答案为:2×24a22.4×5或3a7.
本题解析:
本题难度:一般