微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用R代表短周期元素,R原子最外层的p亚层上的未成对电子只有2个.下列关于R的描述中正确的是( )
A.R的氧化物都能溶于水
B.R的最高价氧化物所对应的水化物都是H2RO3
C.R的都是非金属元素
D.R的氧化物都能与NaOH溶液反应
参考答案:C
本题解析:
本题难度:一般
2、选择题 按照原子核外电子排布规律:各电子层最多容纳的电子 数为2n2(n为电子层数,其中,最外层电子数不超过8 个,次外层电子数不超过18个)。1999年已发现了核电 荷数为118的元素,其原子核外电子层排布是
[? ]
A.2,8,18,32,32,18,8
B.2,8,18,32,50,8
C.2,8,18,32,18,8
D.2,8,18,32,50,18,8
参考答案:A
本题解析:
本题难度:简单
3、填空题 A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)F元素在周期表中的位置_ 91exam.org_____,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:______.
(2)D、F的气态氢化物,沸点较高的是______(填分子式).
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH______7(填“>”“<”或“=”),原因是______.
参考答案:A元素的原子半径是所有原子中最小的,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,Y为硝酸铵,则C为氮元素;A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,则E为钠元素;D、F同主族,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物,则D为氧元素,F为硫元素;
(1)硫原子有3个电子层,最外层电子数为6,则在周期表中第三周期第ⅥA族,只有钠为金属,则氢氧化钠的碱性最强,其电子式为
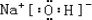
,
故答案为:第三周期第ⅥA族;
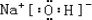
;
(2)因D、F的气态氢化物分别为H2O、H2S,水分子之间含有氢键,则沸点高,故答案为:H2O;
(3)A单质与C单质在一定条件下可化合为Z,则Z为氨气,pH=a的氨水溶液中加入等体积pH=b的硝酸的水溶液,且a+b=14,则反应后为氨水和硝酸铵的混合溶液,溶液pH>7,弱电解质的电离大于盐类的水解,故答案为:>;弱碱与盐的混合溶液真弱碱的电离大于盐中弱碱阳离子的水解.
本题解析:
本题难度:一般
4、填空题 A、B、C和D等4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B在周期表中的位置第______周期,第______族;
(2)A、B形成的化合物的电子式______;
(3)C的元素名称______,C的最高价氧化物的化学式______;
(4)D的最高价氧化物对应的水化物的化学式______.
参考答案:A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B在第二周期第ⅤA族,即B为N元素;C元素原子的最外层电子数比次外层少2个,则C有3个电子层,最外层电子数为6,即C为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D为第四周期第ⅠA族元素,即D为K元素,
(1)B为N元素,位于元素周期表中第二周期第ⅤA族,故答案为:二;第ⅤA族;
(2)A、B形成的化合物为NH3,其电子式为
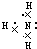
,故答案为:
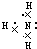
;
(3)C为S元素,其名称为硫,最外层电子数为6,则最高正价为+6,所以最高价氧化物的化学式SO3,故答案为:硫;SO3;
(4)D为K,其最高价氧化物对应的水化物的化学式为KOH,故答案为:KOH.
本题解析:
本题难度:一般
5、简答题 A、B、C、D、E、F六种元素的原子序数依次递增.已知:①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)下列叙述正确的是______?(填序号);
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大与最小的两种元素形成的晶体化学式为EB,属于离子晶体
D.晶格能:NaCl<DCl2
(2)F的核外电子排布式是______;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素是______(填元素符号);
(3)A与C形成的非极性分子中,σ键与π键的键数之比为______.
参考答案:A、B、C、D、E、F六种元素的原子序数依次递增.除F元素外,其余的均为短周期主族元素.
①F的原子序数为29,则F为铜元素;④A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;C核外电子排布式为1s22s22p4,则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;
②E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素.③D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素.
(1)A.D为镁元素,E为铝元素,铝离子半径小于镁离子半径,所以金属键D<E,故A错误;
B.同周期自左而右基态原子第一电离能增大,所以D>E,故B正确;
C.五种元素中,电负性最大是氧元素,电负性最小是镁元素,的两种元素形成的晶体化学式为MgO,属于离子晶体,故C正确;
D.晶格能禽大,其离子键盘牢固,离子晶体愈稳定,离子半径钠离子大于镁离子,氯化钠中离子键更强,晶格能:NaCl>MgCl2,故D正确.
故选:BC.
(2)F为铜元素,核内质子数为29,核外电子数为29,核外电子排布式是1s22s22p63s23p63d104s1;
与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素,价层电子排布为3d54s1,核外电子排布式是1s22s22p63s23p63d54s1,是Cr元素.
故答案为:1s22s22p63s23p63d104s1;Cr.
(填元素符号);
(3)A为碳元素,C为氧元素,A与C形成的非极性分子为CO2,碳原子与氧原子之间形成双键,双键中含有1个σ键、1个π键,分子中共含有2个σ键、2个π键,所以分子中,σ键与π键的键数之比为 1:1.
故答案为:1:1.
本题解析:
本题难度:一般