微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 按下图装置进行实验,并回答下列问题
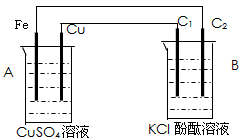
(1)判断装置的名称:A池为___________ B池为___________
(2)铁极为__________极,电极反应式为________________________石墨棒C2附近发生的实验现象为
______________________________
(3)当C2极产生2.24L气体(标准状态)时,铁的质量变化(增加或减少)____了 ____g.CuSO4溶液的质量变化(增加或减少)____ 了____g
2、选择题 从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7X+5FeSO4+12H2SO4,下列说法正确的是
A.X的化学式为CuS,它既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
3、计算题 (1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。锌片上发生的电极反应:
___________________;银片上发生的电极反应:____________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为
47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA = 6.02×1023/mol,电子电荷为1.60×10-19 C)
4、计算题 硝酸是重要的化工原料。在硝酸工业生产中产生的尾气可用纯碱溶液吸收,有关的化学反应有(①式不完整,未配平);
NO2+NaCO3==NaNO2+________+CO2①
NO+NO2+Na2CO3==2NaNO2+CO2②
请按要求回答下列问题:
(1)①式中缺少的产物化学式为______________,其中氧化剂与还原剂物质的量之比为___________。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需n(Na2CO3·10H2O)为_____________。
(3)现有1000g质量分数为21.2%的纯碱吸收液,在20℃用于吸收硝酸厂工业尾气。已知当产生22.4L(标准状况)CO2时,吸收液质量增加44g,求此时溶液中主要阴离子物质的量之比约为_____________。
5、选择题 氢氧燃料电池用于航天飞船,电极反应产生的水经冷凝后可供航天员饮用,其负极电极反应式为:
2H2 +4OH--4e-==4H2O;正极电极反应式为:O2+2H2O+4e-== 4OH-。试计算当得到1. 8L饮用水时,电池内转移电子物质的量约为
[? ]
A.1. 8mol
B.3.6mol
C.100mol
D.200mol