微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是(?)
A.150 mL 1 mol·L-1的NaCl
B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 3 mol·L-1的KCl
D.75 mL 2 mol·L-1的CaCl2
参考答案:C
本题解析:50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度是3mol·L-1 ;A.150 mL 1 mol·L-1的NaCl,溶液中氯离子浓度是1mol·L-1;B.75 mL 2 mol·L-1的NH4Cl溶液中氯离子浓度是2mol·L-1;C.150 mL 3 mol·L-1的KCl,溶液中氯离子浓度是3mol·L-1;D.75 mL 2 mol·L-1的CaCl2溶液中氯离子浓度是4mol·L-1。故选C。
点评:解答本题学生需要注意的是物质的量浓度时标量,只要浓度确定,不随体积变化而变化。
本题难度:一般
2、填空题 12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 gCO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
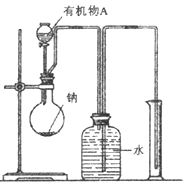
(1)有机物A的分子式?。
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为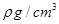 )的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为?(可以不化简)。
)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为?(可以不化简)。
参考答案:(1)C3H8O(2分)?
(2)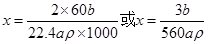 (其它部分化简的表达式均可得分)(2分)
(其它部分化简的表达式均可得分)(2分)
本题解析:(1)根据阿伏加德罗定律可知,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,则该化合物的相对分子质量为30×2=60,则12g有机物的物质的量是
12g÷60g/mol=0.2mol
n(H2O)=14.4g÷18/mol=0.8mol
n(CO2)=26.4g÷44/mol=0.6mol
所以12.0g有机物中含有:m(C)=0.6mol×12g/mol=7.2g
m(H)=2×0.8mol×1g/mol=1.6g
则m(O)==12.0g-7.2g-1.6g=3.2g
n(O)=3.2g÷16g/mol=0.2mol
所以有机物中含有:N(C)=3,N(H)=8,N(O)=1
则有机物分子式为C3H8O
(2)amL(密度为ρg/cm3)的有机物A的质量为:m=aρg
物质的量为:aρg÷60g/mol=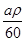 mol
mol
量筒液面读数为bml,即生成氢气的体积为bml
则n(H2)=0.001bL÷22.4L/mol
则C3H8O+xNa C3H(8-x)ONa+0.5xH2
C3H(8-x)ONa+0.5xH2
1?0.5x
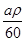 mol?
mol?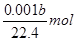
解之得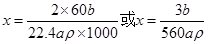
点评:该题是基础性试题的考查,试题贴近教材,紧扣基础,有利于调动学生的学习兴趣和学习积极性,难度不大。该题的关键是根据原子守恒法来解答,有助于培养学生的规范答题能力。
本题难度:一般
3、简答题 今欲用NaOH固体配制500mL?0.2mol/L的NaOH溶液.根据题意填空:
(1)配制该溶液应选用______ mL容量瓶.
(2)用______称取______ g固体NaOH3.
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用______搅拌至完全溶解.待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶.
(4)用少量蒸馏水______烧杯2-3次,并将每次洗涤的溶液都注入容量瓶,轻晃动容量瓶,使溶液混和均匀.
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约2-3厘米时,改用______滴加蒸馏水至液面与刻度线相切.盖好瓶塞,摇匀.
(6)配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中
(7.)下列操作会导致配制溶液浓度偏高的是______(不定项选择)
A.定容时俯视
B.定容时仰视
C.选用的容量瓶内有少量蒸馏水
D.在烧杯中溶解后,有部分溶液外溅
E.称量的固体已有部分潮解
F.没有冷却就将溶液转移到容量瓶.
参考答案:(1)配制500mL?0.2mol/L的NaOH溶液,故需要500mL容量瓶;
故答案为:500;
(2)用托盘天平称量氢氧化钠,称取氢氧化钠的质量为0.5L×0.2mol?L-1×40g/mol=4.0g;.
故答案为:托盘天平,4.0;
(3)溶解氢氧化钠固体,利用玻璃棒搅拌,加速溶解;
故答案为:玻璃棒;
(4)玻璃棒、烧杯壁沾有少量氢氧化钠,应洗涤,并将洗涤液移入容量瓶;
故答案为:洗涤;
(5)加水定容时,直到液面离刻度线约2-3厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
故答案为:胶头滴管;
(6)过长时间存放可能会造成容量瓶的腐蚀,影响测定结果,短期内用容量瓶可以暂时储存,长期最好转移到试剂瓶内保存;
故答案为:不能;
(7)A.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所配溶液浓度偏高,故A符合;
B.定容时,仰视容量瓶刻度线,使溶液的体积偏大,所配溶液浓度偏低;故B不符合;
C.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故C不符合;
D.在烧杯中溶解后,有部分溶液外溅,移入容量瓶内溶质的物质的量减小,所配溶液浓度偏低,故D不符合;
E.称量的固体已有部分潮解,实际称量的氢氧化钠的质量偏小,所配溶液浓度偏低,故E不符合;
F.氢氧化钠溶解,放出大量的热,未冷却就立即转移到容量瓶中,并进行定容,冷却后导致溶液的体积偏小,所以配制溶液的浓度偏大,故F符合;
故选AF.
本题解析:
本题难度:一般
4、选择题 有下列五瓶溶液,其所含离子、分子总数的大小顺序是?
①10 mL 0.60 mol·L-1NaOH水溶液?②20 mL 0.50 mol·L-1 ?H2SO4水溶液?③30 mL 0.40 mol·L-1 HCl水溶液?④40 mL 0.30 mol·L-1 CH3COOH溶液?⑤50 mL 0.20 mol·L-1蔗糖水溶液?
A.①>②>③>④>⑤?
B.②>①>③>④>⑤?
C.②>③>④>①>⑤?
D.⑤>④>③>②>①?
参考答案:D
本题解析:因为问的是各瓶溶液所含离子、分子总数的大小,溶质的量小,这就取决于溶液中的水的多少,所以哪种溶液体积大,哪种所含离子、分子总数就多。故有⑤>④>③>②>①。
本题难度:简单
5、选择题 欲配制100ml 0.10mol/L的KCl溶液,需要使用的仪器有
A.玻璃棒
B.烧杯
C.分液漏斗
D.100ml容量瓶