微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在铜的催化作用下氨气和氟气反应得到一种铵盐和一种三角锥形分子A,则下列有关说法正确的是(?)
A.上述反应的化学方程式为:4NH3+3F2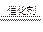 NF3+3NH4F
NF3+3NH4F
B.上述反应中产生的铵盐应为NH4H
C.上述三角锥形分子是由极性键形成的非极性分子
D.上述反应中氟气的氧化性比A分子的氧化性弱
参考答案:A
本题解析:解决本题的关键在于三角锥形分子的结构模型,NH3、NF3等属三角锥形分子,同时生成铵盐,从定义分析,铵根离子与酸根离子结合的产物为铵盐,故为NH4F,所以,A选项符合。
本题难度:简单
2、选择题 将盛有氮气和二氧化氮(假设无N2O4)混合气体的试管倒立于水中,经过足够长时间后,试管内气体的体积缩小为原来的一半,则原混合气体中氮气与二氧化氮的体积比是(?)
A.1:1
B.1:2
C.1:3
D.3:1
参考答案:C
本题解析:
正确答案:C
3NO2+H2O=NO+2HNO3? △n
3?1? 2
3v/4? v/4? v/2
余下的NO 、N2共v/2?,其中NO是v/4,则N2也是v/4, NO2为3v/4,原混合气体中氮气与二氧化氮的体积比是1:3
本题难度:简单
3、填空题 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变? b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变? d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。

⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
参考答案:(1)bc? 2.67或8/3,(2)(NH4)3PO4或(NH4)2HPO4或NH4H2PO4
(3)负?O2+4e-+2CO2=2CO32-,(4)①1∶7
②对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应(意思相近均给分)
本题解析:(1)a.随反应进行,气体的物质的量不变,压强不变,体系压强保持不变,不能说明到达平衡状态,a错误;b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,b正确;c.随反应进行NO和O2的物质的量之比发生变化,NO和O2的物质的量之比保持不变,说明到达平衡状态,c正确;d.每消耗1mol SO2的同时生成1mol NO都表示正反应速率,反应自始至终都按此比例进行,d错误.
选:bc.
NO2(g)+SO2(g)?SO3(g)+NO(g)?
起始物质的体积? a? 2a? 0? 0
转化物质的体积? x? x? x? x
平衡物质的体积? a-x? 2a-x? x? x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x= ,故平衡常数K
,故平衡常数K
=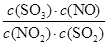 =
=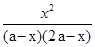 =
=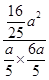 ≈2.67,
≈2.67,
(2)氨气是碱性气体,可以和磷酸反应生成盐,产生的盐随着酸的磷酸的量的多少而不同,可以产生磷酸铵,磷酸氢铵或是磷酸二氢铵;
(3)碳酸盐燃料电池中通氧气的电极一定为正极,通入燃料的电极一定为负极,氧气在该电极上发生还原反应;
(4)①设NO的物质的量是x,NO2的物质的量是y,则
x+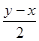 =
=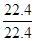 mol;
mol;
32x+24(y-x)=44
解得:x= ,y=
,y=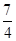 ;即一氧化氮和二氧化氮的物质的量之比
;即一氧化氮和二氧化氮的物质的量之比 :
: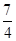 =1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,故答案为:1:7.
=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,故答案为:1:7.
②NO不能与Na2CO3溶液反应,所以对于含NO较多混合气体无法完全吸收,故答案为:含NO较多混合气体无法完全吸收;
本题难度:困难
4、填空题 在浓硝酸中放入铜片:
(1)开始反应的化学方程式为_________________。
(2)若铜有剩余,则反应将要结束时的反应化学方程式是______________________。
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因和离子方程式是_____?。
?。
(4)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________,
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑
(3)H2SO4提供H+,NO3-继续与Cu发生反应:3Cu+8H++2NO3- ===3Cu2++2NO↑+4H2O
(4)0.65 mol
本题解析:浓硝酸具有氧化性,可以氧化铜,方程式为Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑。随着反应的进行,硝酸的浓度会逐渐变稀,所以此时发生的反应是3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑。反应结束后在溶液中有硝酸铜,当加入少量25%的稀硫酸,溶液就会电离出大量当氢离子,从而是NO3-具有氯氧化性,可继续氧化铜。离子方程式为3Cu+8H++2NO3- ===3Cu2++2NO↑+4H2O。5.6 L气体是NO和NO2的混合气体,其物质的量是0.25mol,所以被还原的硝酸是0.25mol。铜是0.2mol,生成硝酸铜也是0.2mol,因此没有被还原的硝酸是0.4mol,所以参加反应的硝酸一共是0.65mol。
本题难度:一般
5、计算题 NO的生物活性已引起科学家高度重视。它与超氧离子(O2— )反应,该反应的产物本题用A为代号。在生理pH值条件下,A的半衰期为1-2秒。A被认为是人生病,如炎症、中风、心脏病和风湿病等引起大量细胞和组织毁坏的原因。A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。科学家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反应等。他们发现,当16O标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反应历程复杂。回答如下问题:(1)写出A的化学式。写出NO跟超氧离子的反应。这你认为A离子的可能结构是什么?试写出它的路易斯结构式(即用短横表示化学键和用小黑点表示未成键电子的结构式)。(2)A离子和水中的CO2迅速一对一地结合。试写出这种物种可能的路易斯结构式。(3)含Cu+离子的酶的活化中心,亚硝酸根转化为一氧化氮。写出Cu+和NO2–在水溶液中的反应。(4)在常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50oC,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改 变,已知其中一种产物是N2O,写出化学方程式。并解释为什么最后的气体总压力略小于原压力的2/3。
参考答案:1)ONO2–? (1分)
NO + O2– = ONO2–? (1分)
 (不要求构型)? (2分)
(不要求构型)? (2分)
2)O2NOCO2– 或ONO2CO2– (把O合在一起写也算正确答案)? (1分)
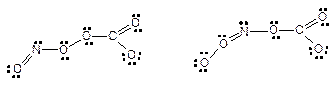 ? (2分)
? (2分)
(不要求构型,但只写一种可能的得一半分)
3)NO2– + Cu+ + 2H+ =" NO" + Cu2+ + H2O(写2OH—也得分)? (2分)
4)3NO = N2O + NO2? (歧化反应)? (2分)
发生2NO2 = N2O4的聚合反应,因此最后压力仅略低于2/3。? (1分)
本题解析:曾经被选为明星分子的NO的生物化学功能在我国举办的第27届国际化学奥林匹克竞赛试题中涉及过,本题的题面表述远比上述试题复杂,为解题而提供的有用的信息掩藏在逻辑复杂的表述中。这或许是命题人有意在考察选手获取信息、综合信息、分析信息的能力。例如在表述中两次提到A是硝酸根的异构体,但并没有直截了当地这样说。硝酸根的异构体除过氧亚硝酸根外不可能是别的,这一点学生似不难得出。而第二问涉及的过氧亚硝酸根离子与二氧化碳分子的结合产物就有两种可能性,显然,写一种是不全面的。本题后两题看答案就能理解,不再赘述。
本题难度:一般