微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成CH4燃料电池.已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-═CO32-+7H2O;通入O2的另一极,其电极反应是:O2+2H2O+4e-═4OH-,下列叙述不正确的是( )
A.通入CH4的电极为负极
B.该电池使用一段时间后应补充KOH
C.正极发生氧化反应
D.该电池工作时溶液中的阴离子向负极移动
参考答案:A、燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,故A正确;
B、电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,所以该电池使用一段时间后应补充KOH,故B正确;
C、正极上氧气得电子发生还原反应,故C错误;
D、放电时,溶液中阴离子流向负极,阳离子流向正极,故D正确;
故选C.
本题解析:
本题难度:简单
2、填空题 (7分)
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一 定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
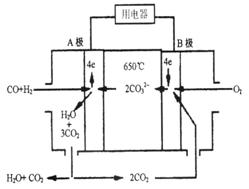
请回答下列问题:
(1)B极发生____(填“氧化”或“还原”)反应
(2)电池总反应为___________________________________________。
(3)以 此电源电
此电源电 解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶
解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶 液体积为1 L,溶液的pH约为 。
液体积为1 L,溶液的pH约为 。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是
(用化学方程式表示)
参考答案:
本题解析:略
本题难度:一般
3、简答题 有些化学反应的化学能能直接转化成电能
I.利用Fe+CuSO4=FeSO4+Cu反应,设计一个原电池:
(1)在右框中画出装置图(标明电解质溶液、正、负极和电极材料)
(2)下列说法中,正确的是______.(填字母)
A.电解质溶液中阳离子向负极移动?B.电子通过外导线由负极流向正极
C.当导线中有1mol电子通过时,理论上正极放出1g气体
D.若所选电极的质量相等,理论上两极质量差为60g,导线中有1mol电子通过
II.三套装置如图所示,A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸.
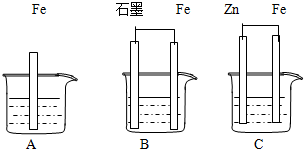
(1)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为______;
(2)若C中电解质溶液是氯化钠溶液,则Fe电极的电极反应式为______;
III.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O?

?2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸.
(1)以下说法中正确的是______①以上反应是可逆反应;?②以上反应不是可逆反应③充电时化学能转变为电能;④放电时化学能转变为电能.
(2)废弃的镍镉电池已成为重要的环境污染物,资料表明一节废镍镉电池可以使一平方米面积的耕地失去作用价值.在酸性土壤中这种污染特别严重,这是因为______
(3)另一种常用的电池是锂电池,锂是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2.
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液______(请用化学方程式表示其原因).
参考答案:I.(1)在Fe+CuSO4=FeSO4+Cu反应中,Fe被氧化,应为原电池的负极,正极为活泼性较Fe弱的金属或非金属,电解质为CuSO4溶液,可设计原电池为,故答案为:
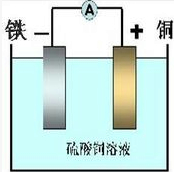
;
(2)A.电解质溶液中阳离子向正极移动,阴离子向负极移动,故A错误;
B.原电池工作时,电子从负极经外电路流向正极,故B正确;
C.正极反应为Cu2++2e-=Cu,无气体生成,故C错误;
D.当有1mol电子通过时,负极铁的质量减少为12mol×56g/mol=28g,正极析出铜的质量为12mol×64g/mol=32g,质量差为60g,故答案为:B、D;
II.(1)B中铁为负极,发生电化学腐蚀,A为化学腐蚀,C铁为原电池的正极,不易被腐蚀,所以腐蚀速率由快到慢的顺序为B、A、C,故答案为:B、A、C;?
(2)若C中电解质溶液是氯化钠溶液,发生吸氧腐蚀,正极反应为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
III.(1)目前常用的镍(Ni)镉(Cd)电池,充电时是将电能转化为化学能,放电时将电能转化为化学能,为不同条件下的反应,不是可逆反应,故答案为:②④;
(2)Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,在酸性土壤中生成生成Ni2+?和Cd2+,导致污染特别严重,
故答案为:Ni(OH)2、Cd(OH)2可被酸溶解,生成Ni2+?和Cd2+;
(3)金属锂较活泼,易与水反应,反应的方程式为2Li+2H2O═2LiOH+H2↑,故答案为:2Li+2H2O═2LiOH+H2↑.
本题解析:
本题难度:一般
4、填空题 (10分)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)?NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L—1的氨水,溶液中随着水量的增加而减小的是_____________(填序号)

(2)标准状况下,将1.12LCO2通入100mL1mol·L—1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为_________________________________________________;
①c(OH—)=2c(H2CO3)+______________________________________________;
②c(H+)+c(Na+)=___________________________________________________。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2=CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则 原电池工作时电解质溶液中向正极移动的离子是_____________。
原电池工作时电解质溶液中向正极移动的离子是_____________。
参考答案:(1)b、d(2分,答对1个得1分,答错1个得0分)
(2)c(Na+)>c(CO32-)>c(OH-)>c(HC O3-)>c(H+)(2分)
O3-)>c(H+)(2分)
①c(H+)+c(HCO3-)(2分)
②2c(CO2-3)+(HCO3-)+c(OH-)(2分)
(3)H+(2分)
本题解析:略
本题难度:简单
5、选择题 一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是
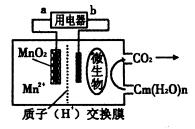
A.电池工作时,电子由a流向b
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H+ +2e— ===Mn2+ +2 H2O