微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图为一原电池的结构示意图,下列说法中,不正确的是( )

A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.盐桥中阳离子流向CuSO4溶液中
参考答案:解;A.该原电池中,负极上锌失电子生成锌离子,正极上铜离子得到生成铜,电池反应式为:Zn+Cu2+=Zn2++Cu,故A正确;
B.该原电池中,易失电子的锌作负极,铜作正极,电子从锌沿导线流向铜,故B正确;
C.原电池工作时,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应,所以正极上有铜单质析出导致CuSO4溶液蓝色变浅,故C错误;
D.原电池工作时,阳离子向正极移动,故D正确.
故选C.
本题解析:
本题难度:一般
2、填空题 (6分)(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________?_______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是?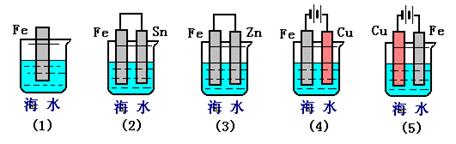
参考答案:(1)X>Y>Z
(2)2H2(g)+O2(g)=2H2O(g)?△H=-483.6 kJ·mol-1
(3)?⑸⑵⑴⑶⑷
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。X、Y组成原电池,X是负极,因此X的金属性强于Y;Y放在Z的硝酸盐溶液中,Y表面有Z析出,则Y的金属性强于Z,所以金属性强弱顺序是X>Y>Z。
(2)氢气和氧气反应生成1mol水蒸气放热241.8 kJ,所以该反应的热化学方程式是)2H2(g)+O2(g)=2H2O(g)?△H=-483.6 kJ·mol-1。
(3)根据装置图可知,(1)装置是铁的化学腐蚀,(2)、(3)是原电池,其中(2)中铁是负极加速腐蚀,(3)中铁是正极,被保护;(4)、(5)是电解池,其中(4)中铁是阴极,被保护,(5)中铁是阳极,失去电子,加快腐蚀,所以铁片腐蚀由快到慢的顺序是⑸⑵⑴⑶⑷。
本题难度:一般
3、简答题 (1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O═4Al(OH)3,负极为______,负极发生______反应(填“氧化”或“还原”),负极反应______;正极为铂网,______?(填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向______?(填“正极”或“负极”).
(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2═2H2O.酸式氢氧燃料电池的电解质是酸,其负极反应为:2H2-4e-═4H+,则正极反应为______;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-═4OH-,则负极反应为:______.
(3)蓄电池Pb+PbO2+2H2SO4
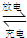
?2PbSO4+2H2O放电时,正极电极反应式______,当电路中通过0.5mol电子时,消耗H2SO4的物质的量______,负极增重______g.
参考答案:(1)根据反应方程式知,活泼的金属作负极,所以负极是Al,负极失电子发生氧化反应;正极为铂网,电子从负极经外电路到正极,电流正好相反,从正极经外电路到负极;正极上聚集大量电子,根据异性相吸,所以钠离子移向正极.
?故答案为:Al;氧化;电流;正极.
(2)酸式氢燃料电池的电解质是酸、
电池总反应式均可表示为:2H2+O2=2H2O①
其负极反应为:2H2-4e-=4H+ ②,
则正极反应为 ①-②,即O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的电解质是碱,
其正极反应表示为:O2+2H2O+4e-=4OH-③,
则负极反应为①-③,即2H2-4e-+4OH-=4H2O
故答案为:O2+4e-+4H+=2H2O; 2H2-4e-+4OH-=4H2O
(3)放电时,该装置是把化学能转化为电能,所以是原电池.原电池中正极上得电子发生还原反应,二氧化铅得电子和硫酸根离子、氢离子反应生成硫酸铅和水,所以电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O
设消耗硫酸xmol
PbO2+2e-+SO42-+4H+=PbSO4+2H2O?转移电子
Pb+PbO2+2H2SO4
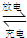
?2PbSO4+2H2O?转移电子
? ?2mol? 2mol
?x mol? 0.5mol?
所以x=0.5mol.
设负极增重yg.
负极电极反应式为:Pb+SO42--2e-=PbSO4 转移电子? 负极增重质量(硫酸铅-铅)
? 2mol? ? 96g
? 0.5mol? ?yg
?y=24g
?
?故答案为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O;0.5mol;24.
本题解析:
本题难度:一般
4、选择题 下列四个图像的有关说法正确的是(?)
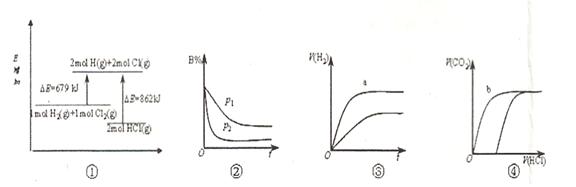
A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ/mol
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D.④表示10mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.lmol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
参考答案:C
本题解析:A不正确,该反应是放热反应,△H小于0;选项B中,根据图像可知,曲线P2德尔斜率大,所以P2大于P1,这说明压强越大,B的百分含量越小,即正反应是体积减小的反应,所以D一定不是气体,B不正确;醋酸是弱酸,在pH相等的条件下,醋酸的浓度大于盐酸的,反应速率快,C正确;碳酸钠和盐酸反应是分步进行的,所以b表示的是碳酸氢钠,D不正确,答案选C。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像 1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平” 。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
本题难度:一般
5、选择题 如图为一原电池的结构示意思,下列说法中,不正确的是( )
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
