微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)2011年6月,云南曲靖陆良化工实业有限公司5000多吨工业废料铬渣非法倾倒导致当地严重污染。+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。工业含铬废水的处理方法之一是将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的NaCl后进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(已知:常温下Ksp Fe(OH)3=2.6×10-39,Ksp Cr(OH)3=6.0×10-31)

(1)若阳极铁质量减少16.8g,则理论上被还原的Cr2O72-的物质的量为?mol。
(2)已知电解后的溶液中c(Fe3+)为2.6×10-13 mol·L-1,则溶液中Cr3+浓度为?mol·L-1。
(3)在下图装置中,观察到图一装置铜电极上产生大量的无色气泡,而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体。根据上述现象试推测金属铬的两个重要化学性质?、? ?。
参考答案:⑴0.05 (2分)
⑵6.0×10-5(2分)
⑶铬比铜活泼,铬在稀硝酸中可以发生钝化(2分,各1分)
本题解析:略
本题难度:一般
2、选择题 下列有关钢铁腐蚀说法正确的是
[? ]
A.钢铁腐蚀时铁作正极
B.钢铁腐蚀时铁发生的反应为:Fe-3e?-?=?Fe3+
C.在碱性环境中正极反应式为:O2+2H2O?+4e-=4OH-
D.在酸性环境中正极反应式为:O2+4H++4e-=2H2O
参考答案:C
本题解析:
本题难度:简单
3、实验题 (14分)某研究小组对铁生锈进行研究:
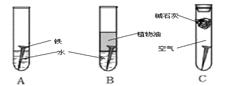
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是?(填字母);
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为:?;?
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是?
A. 锡? B. 铜? C. 锌?
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:
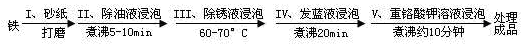
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
参考答案:(1)A (3分)?(2)O2+2 H2O+4e-= 4 OH-(3分)
(3)C (3分)?(4)铁制品表面有红色固体析出(3分)
本题解析:(1)植物油能阻止空气,碱石灰能吸收CO2和水,实验最容易发生腐蚀的是A。
(2)水是中性的,所以铁发生的是吸氧腐蚀,正极反应式为O2+2 H2O+4e-= 4 OH-。
(3)镀层就是最好式金属性强于的铁,这样即使镀层破损,发生电化学腐蚀,铁也是正极,被保护,因此答案选C。
(4)如果不合格,则铁就能和硫酸铜发生置换反应,生成红色的铜,因此现象是铁制品表面有红色固体析出。
本题难度:一般
4、选择题 据环保部门测定,我国一些大城市的酸雨pH=3.5.在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极主要发生的反应是( )
A.2H++2e-=H2↑
B.2H20+02+4e-=40H-
C.Fe-2e-=Fe2+
D.40H--4e-=2H20+02↑
参考答案:酸雨、铁制品构成了原电池.
A、碳作正极,溶液中的氢离子得电子生成氢气,2H++2e-=H2↑,故A正确;
B、该反应是析氢腐蚀,故B错误;
C、负极上铁失电子,故C错误;
D、正极上发生析氢反应,故D错误;
故选A.
本题解析:
本题难度:简单
5、选择题 下列合金中不能被稀盐酸腐蚀的是(括号内为合金成分)
A.球墨铸铁
B.黄铜(铜锌)
C.铝合金
D.18K黄金
参考答案:D
本题解析:前三个选项中均含有较活泼的金属,均可和盐酸反应,故答案为D。
本题难度:简单