微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列做法不利于金属防护的是( )
A.菜刀切菜后不洗净就放回刀架
B.将钢铁制成不锈钢
C.在铁塔的表面喷上一层油漆
D.埋在地下的钢管与锌块连接
参考答案:A、菜刀切菜后和水接触易生锈,故A正确;
B、将钢铁制成不锈钢后,不锈钢的性能好于钢铁,不易生锈,故C错误;
C、在铁塔的表面喷上一层油漆,可以防止金属和水以及空气接触,故C错误;
D、埋在地下的钢管与锌块相连后,形成原电池,金属铁做正极,该极金属被保护,不易生锈,故D错误.
故选A.
本题解析:
本题难度:简单
2、实验题 (14分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
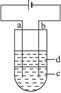
(1)a电极材料应为________________________________________,电极反应式为
_______________________________________________________;
(2)电解液c可以是(填编号)(?)
A.纯水? B.NaCl溶液? C.NaOH溶液? D.CuCl2溶液
(3)d为苯,其作用为______________________________________________________,在加入苯之前对c应作怎样的简单处理?
______________________________________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)(?)
A.改用稀硫酸作电解液?
B.适当增大电源的电压
C.适当减少两电极间距离?
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为________________________________。
参考答案:(1)Fe? Fe-2e-====Fe2+
(2)BC
(3)隔绝空气,防止Fe(OH)2被空气氧化?加热一段时间
(4)BC
(5)白色沉淀立即变为灰绿色,最终变为红褐色
本题解析:要想制得Fe(OH)2,必须有Fe2+和OH-,所以铁必须作阳极,本身溶解成Fe2+。电解质溶液电解后,应存在大量的OH-,NaCl溶液电解,阴极H+放电后,产生了OH-,NaOH溶液电解,实际上电解了H2O,也有OH-。为了防止Fe(OH)2被氧化,要隔绝空气,并把溶液中的氧气赶走。为了快速产生白色沉淀,要加快反应速率,并使得两电极间距离适当减少。反接电源电解,原阴极4OH--4e-====O2↑+2H2O,产生氧气会把Fe(OH)2氧化成Fe(OH)3。
本题难度:简单
3、选择题 下列情况下,能使反应Cu+Zn2+===Cu2++Zn发生的是( )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化锌作电解质溶液
B.铜锌合金在潮湿空气中发生电化学腐蚀
C.用锌片作阴、阳电极,电解硫酸铜溶液
D.用铜片作阴、阳电极,电解硫酸锌溶液
参考答案:D
本题解析:铜金属性弱于锌的,该反应是不能自发进行的,因此要实现该反应,只能是通过电解法。根据方程式可知,铜失去电子,所以铜是阴极,电解 91exam.org质溶液是硫酸锌,答案选D。
本题难度:一般
4、选择题 钢铁发生电化腐蚀时,正极上发生的反应是
A.2H++2e-=H2↑
B.2H2O+O2+4e-=4OH-
C.Fe-2e-=Fe2+
D.4OH--4e-=O2↑+2H2O
参考答案:B
本题解析:原电池中较活泼的金属做负极,失去电子发生氧化反应。电子经导线传递到正极,所以正极得到电子,发生还原反应。在钢铁的电化学腐蚀中,负极是铁失去电子。铁主要是以吸氧腐蚀为主,因此正极是溶解在水中的氧气得到电子,所以正极电极反应式为2H2O+O2+4e-=4OH-,B正确。A是析氢腐蚀中的正极反应式,C是负极反应式,D是电解池中阳极反应式,所以答案选B。
本题难度:简单
5、填空题 (14分)下图是一个化学过程的示意图。已知甲池的总反应式为: 2CH3OH+3O2+4KOH?2K2CO3+6H2O?填写下列空白:

(1)请写出甲、乙两池的名称。甲电池是?,乙池是?。
(2)甲池中通入CH3OH的电极名称是?,电极反应方程式为?;乙池中B(石墨)电极的名称是?。
(3)电解过程中,乙池溶液pH的变化为(“升高”、“降低”或“不变” )?。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O?2?mL(标准状况下)
参考答案:(14分)
(1)原电池、电解池
(2)负极、CH3OH - 6 e- + 8OH— = CO32— + 6H2O?阳极
(3)降低
(4)280
本题解析:略
本题难度:一般