微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对化学反应方向的叙述,正确的是
A.室温下不能自发进行的反应,在高温下有可能自发进行
B.熵增加有利于反应的自发进行,熵减少的反应常温下都不会自发进行
C.非自发反应在任何情况下都不会发生
D.ΔH-TΔS作为化学反应方向的判据,在任何条件下都适用
参考答案:A
本题解析:A、如果ΔH>0,△S>0,室温下不能自发进行的反应,在高温下有可能自发进行,正确;B.如果ΔH<0,△S<0时,熵减少的反应常温下会自发进行,错误;C.非自发反应在外界条件改变时可能会自发进行反应,错误;D.反应的自发性是指没有外界干扰式体系的性质,所以D也是错误的,
本题难度:一般
2、填空题 煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
试回答下列问题
⑴上述正向反应是???反应(填“放热”或“吸热”)。
⑵在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有???(选填A、B、C、D、E)。
?
| n(CO)
| n(H2O)
| n(H2)
| n(CO2)
|
A
| 1
| 5
| 2
| 3
|
B
| 2
| 2
| 1
| 1
|
C
| 3
| 3
| 0
| 0
|
D
| 0.5
| 2
| 1
| 1
|
E
| 3
| 1
| 2
| 1
|
⑶已知在一定温度下:
C(s)+CO2(g) 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g) CO(g)+H2(g)?平衡常数K1;
CO(g)+H2(g)?平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
则K、K1、K2之间的关系是K=???。
⑷若在500℃时进行,设起始时CO和H2O的起始浓度均为0.010mol/L,在该条件下,CO的平衡转化率为:???。
⑸若反应在800℃进行,设起始时CO(g)和H2O(g)共为1mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=???。
参考答案:⑴放热?⑵BCD?⑶K1/K2?⑷75%?⑸X
本题解析:(1)根据表中数据可知,随着温度的升高,平衡常数减小,说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。
(2)由于反应前后体积不变,所以设容器的容积是1L,则ABCD中 的比值分别是
的比值分别是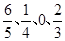 ,所以其中向正反应方向移动的有BCD。
,所以其中向正反应方向移动的有BCD。
(3)根据盖斯定律可知,①-②即得到C(s)+CO2(g) 2CO(g),所以该反应的平衡常数K=
2CO(g),所以该反应的平衡常数K=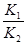 。
。
(4)? CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 0.010? 0.010? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)0.010-x? 0.010-x? x? x
则根据平衡常数表达式可知
解得x=0.0075mol/L
则在该条件下,CO的平衡转化率为75%
(5)? CO(g)+H2O(g) H2(g)+ CO2(g)
H2(g)+ CO2(g)
起始浓度(mol/L) 1-x? x? 0? 0
转化浓度(mol/L)(1-x)y?(1-x)y?(1-x)y (1-x)y
平衡浓度(mol/L)1-x-y+xy? x -y+xy?(1-x)y (1-x)y
则根据平衡常数表达式可知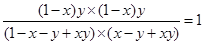
解得x=y
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、选择题 将1molCO和1molH2O充入容器中,在催化剂存在下发生反应
H2O (g) + CO(g)  H2 (g) + CO2(g)
H2 (g) + CO2(g)
达到平衡时,发现有50%的CO转化为CO2。在其他条件不变的情况下,若将1molCO和2molH2O充入反应器中,则反应达平衡后,混合气体中CO2的体积分数可能为(?)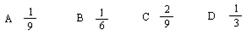
参考答案:C
本题解析:若转化率为50%,CO2的体积分数为1/6,若转化率为100%,CO2的体积分数为1/3,由于CO的转化率介于50%——100%之间,所以CO2的体积分数介于1/6——1/3之间。
本题难度:简单
4、计算题 一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:
(1) 用H2O(g)表示该反应的反应速率?
(2)达到平衡时,CO的转化率为多少?
参考答案:(1)0.1mol/(L·min)?(2) 50%
本题解析:考查可逆反应的有关计算。
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 2? 2? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)(2-x)?(2-x)? x? x
则根据平衡常数表达式可知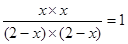
解得x=1mol/L
所以水蒸气的反应速率是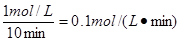
CO的转化率是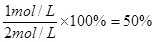
本题难度:一般
5、选择题 下列有关说法正确的是
A.铅蓄电池在放电时,两极质量均增加
B.钢铁在中性溶液中主要发生析氢腐蚀
C.在室温下能自发进行的反应,其△H一定小于0
D.0.1 mol·L-1Na2S溶液加水稀释时,n(Na+)/n(S2-)值将减小
参考答案:A
本题解析:A项铅蓄电池在放电时,负极:Pb→PbSO4,正极:PbO2→PbSO4,两极质量均增加,正确;B项钢铁在中性溶液中主要发生吸氧腐蚀,错误;C项在室温下能自发进行的反应,也可能是熵增,其△H大于0的反应,错误;D项在Na2S溶液中加水稀释时,促进S2-的水解,n(Na+)/n(S2-)值将增大,错误。
本题难度:一般