微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题&nb sp; (16分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为 了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
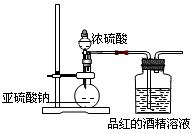
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。
①?;? ②?.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒
精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导
致。为此,SO2能使品红的水溶液褪色的可能微粒有?。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量
亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品
红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确?,其理由
是?。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“?”内容。
同浓度溶液
| SO32-
| HSO3-
| H2SO 3 3
| 褪色速度
|
Na2SO3溶液
| 多
| 少
| 少
| 快
|
NaHSO3溶液
| 较上面?
| 较上面?
| 较上面?
| 慢
|
②根据实验和分析,得出的结论是?。
参考答案:(16分)(1)①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);(2分)
②没有尾气吸收装置?(2分)
(2)H2SO3、HSO 、SO
、SO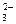 (3分)
(3分)
(3)不正确(1分),因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸。(3分)
(4)①(3分)
同浓度溶液
SO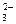
HSO
H2SO3
褪色速度
Na2SO3溶液
多
少
很少
快
Na HSO3溶液
较上面少
较上面多
较上面多
慢
本题解析:略
本题难度:一般
2、选择题 研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是?
[?]
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.核磁共振氢普通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
参考答案:C
本题解析:
本题难度:简单
3、实验题 (10分)现有X、Y、Z三种非金属元素,A、B、C三种金属元素,已知有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
(3)XZ易溶于水,XZ的水溶液可使石蕊试液变红。
(4)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体。
(5)Z的单质溶于X2Y中所得溶液具有漂白性。
(6)A的单质可以在Z的单质中燃烧,生成棕褐色固体,该固体溶于水呈棕黄色溶液。
(7)B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成。
(8)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色。
请完成下列问题:
①写出XZ、X2Y和BZ2的化学式:XZ________,X2Y________,BZ2________。
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是________(填化学式)。
③A的单质与Z的单质反应的化学方程式:________________________。
④C的单质与Y单质反应生成淡黄色物质的化学方程式:________________________。
⑤Z单质能否与NaOH溶液反应?________(填“能”或“不能”)。若能,请写出反应的离子方程式:________________________。(若不能反应,则此空不必填写)
⑥向盛有紫色石蕊试液的试管中持续地通入氯气,溶液发生的颜色变化是__________,理由是________________________。
参考答案:①HCl H2O CuCl2 ②HClO ③2Fe+3Cl22FeCl3 ④2Na+O2Na2O2 ⑤能 2OH-+Cl2===Cl-+ClO-+H2O ⑥溶液由紫色变为红色,又变为无色 Cl2+H2O===HCl+HClO,石蕊遇盐酸变红,HClO具有强氧化性,使有机色质退色?
本题解析:从题目叙述不难发现,A为铁元素,B为铜元素,C为钠元素。X为氢元素,Y为氧元素,Z为氯元素。
本题难度:一般
4、实验题 文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究:
(1) 提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有?。
(2) 设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
实验步骤
| 预期现象和结论
|
步骤1:取适量酸雨于A、B两支洁净试管中,待用。
| ?
|
步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤。
| ?
|
步骤3:取少量步骤2得到的滤渣加入足量的盐酸。
| ?
|
步骤4:取少量步骤2得到的的滤液,加入?
?。
| ?
?
|
步骤5:往B试管中加入?
?。
| ?
?
参考答案:(12分)(1)SO2(或H2SO3)(2分)
(2)每空2分
实验步骤
预期现象和结论
步骤3:
若滤渣不完全溶解则酸雨中含有硫酸
步骤4:取少量步骤2得到的的滤液,加入过量的硝酸银,然后加入少量的硝酸银溶液
若产生白色沉淀,则酸雨中含有盐酸
步骤5:往B试管中加入几滴品红溶液,振荡
若品红溶液褪色,则所以中含有亚硫酸或SO2
本题解析:(1)由于酸雨中硫酸是亚硫酸被氧化后生成的,所以 主要溶质还一定有亚硫酸或SO2。
(2)由于硫酸钡和亚硫酸钡都是不溶于水的白色沉淀,但硫酸钡还不能溶于酸中,所以步骤3中,预期的现象和结论应该是:若滤渣不完全溶解则酸雨中含有硫酸;氯离子的检验一般用硝酸酸化的硝酸银溶液,所以步骤4应该是:取少量步骤2得到的的滤液,加入过量的硝酸银,然后加入少量的硝酸银溶液。预期的现象和结论应该是:若产生白色沉淀,则酸雨中含有盐酸。SO2的检验一般用品红溶液,所以步骤5应该是:往B试管中加入几滴品红溶液,振荡。预期的现象和结论应该是:若品红溶液褪色,则所以中含有亚硫酸或SO2。
点评:该题是高考中的常见考点,属于中等难度的试题。试题难易适中,侧重对学生基础性知识的巩固与训练,有助于培养学生综合实验能力和规范严谨的实验实际能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、实验题 (12分) 甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:?
?;
(2)丙同学认为乙同学的猜想也不正确,他的理由是?
?。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
实验步骤
| 设计这一步骤的目的
| 1.将配制的氢氧化钠溶液加热??
| ?
| 2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油?
| ?
|
(4)通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,大家能设计实验证明吗?
实验方法
| 可能观察到的现象和结论
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。
| 物质的量浓度大的溶液中酚酞红色消失
证明?
| 方案二:向原红色消失的溶液中加?
(填试剂名称)
| 红色重新出现,则说明红色消失与氢氧化钠物质的量浓度大小有关
参考答案:⑴若酚酞变质,刚开始溶液就不会变红色了。
⑵氢氧化钠溶液与空气中的二氧化碳反应生成碳酸钠和水,碳酸钠水溶液显碱性,红色不会消失。
⑶①除去溶液的氧气?②利用植物油隔绝空气
⑷①红色消失与氢氧化钠的物质的量浓度大小有关?②水
本题解析:本题以实验探究为题材,考查学生的分析问题和解决问题的能力;(1)酚酞遇碱变红色,如果酚酞变质,则开始加入时就不能变成红色,故甲的说法不正确;(2)氢氧化钠与二氧化碳反应后生成碳酸钠溶液,碳酸钠溶液呈碱性,会使酚酞试液变红,故乙的说法也不正确;(3)丙同学先把氢氧化钠加热,是为了排净溶液中溶解的氧气,再加植物油是为了使试液与空气隔绝,防止发生氧化反应;(4)在丁同学的猜想中,如果在不同浓度的氢氧化钠溶液中,物质的量浓度大的溶液里酚酞的红色消失,则证明红色消失与氢氧化钠的物质的量浓度大小有关;若向红色消失的溶液中继续加水,红色重现,则证明其结论是正确的。
本题难度:简单
|
|