微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 在进行某实验探究过程中,一些学生发现等质量的铜片分别与等体积(均过量)的浓硝酸和稀硝酸反应,所得溶液前者为绿色,后者为蓝色。
针对这种现象,学生们进行了讨论后,出现了以下两种观点:
一种认为,这可能是Cu2+浓度的差异引起的。你同意这种看法吗??(填“同意”或“不同意”),原因是?。
另一种认为,呈“绿色”是Cu2+与NO2混合的结果。请你设计出一个实验方案证明之,你设计的实验方案是??
已知0.3mol Cu与足量的稀硝酸反应,则被还原的HNO3的物质的量是?mol。
参考答案:不同意(1分)?浓硝酸、稀硝酸均过量,Cu全部转化为Cu2+,则在同体积的溶液中Cu2+浓度相同、溶液颜色应该相同(2分)
加水稀释看能否由绿色变为蓝色(2分,其它合理答案均可)
0.2mol(2分)
本题解析:因溶液的颜色由有色离子的浓度来决定,而Cu2+浓度相同,颜色应该相同,故答案为:不同意; 浓硝酸、稀硝酸均过量,Cu全部转化为Cu2+,则在同体积的溶液中Cu2+浓度相同、溶液颜色应该相同。
因除去NO2若颜色变蓝,则是由于Cu2+与NO2混合的结果,故答案为:加水稀释看能否由绿色变为蓝色。
Cu与足量的稀硝酸反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,在这个方程式中我们可以知道有2mol硝酸被还原成NO,参加反应的硝酸与被还原的硝酸的物质的量之比是4:1,而0.3molCu和0.8molHNO3完全反应,所以硝酸物质的量为0.8mol,则被还原的HNO3物质的量是0.2mol。
点评:本题主要考查了铜与硝酸的反应,根据问题情景,运用所学知识来解决问题,培养了学生分析问题解决问题的能力,题目难度中等。
本题难度:一般
2、实验题 (9分)有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应。请回答下列问题:
(1)第一小组同学设计如图装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。

甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,则反应的化学方程式为___________________________。
乙同学认为Na2O:与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,该同学设计了如下方案:

你认为乙同学的方案是否合理____________(答“是”或“否”);请简要说明两点理由:
①__________________________________________________________________________
②__________________________________________________________________________.
(2)第二小组同学利用下图中的有关装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。已知:H2C2O4  ?CO2↑+CO↑+H2O
?CO2↑+CO↑+H2O
(乙二酸)?

若CO能够与Na2O2发生反应,则预测反应产物为______________________;验证该产物可选择的试剂是___________________________________________________。
上述实验中选择的最简单的装置接口连接顺序为_________________________.
参考答案:(1) ;否(1分)
;否(1分)
①稀HNO3可以把BaSO3氧化为BaSO4(1分)
②若反应后的固体有Na2O2残留,溶于水后可把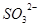 氧化为
氧化为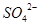 (1分)
(1分)
(2)Na2CO3(1分);稀 (或稀HC1)和澄清石灰水(1分);a b c f(2分)
(或稀HC1)和澄清石灰水(1分);a b c f(2分)
本题解析:(1)仿照CO2与过氧化钠的反应方程式可写出或直接配平:
(2)本质是检验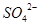 的存在,该方案明显不合理:
的存在,该方案明显不合理:
①原溶液中即使没有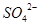 ,但
,但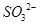 与加入的氯化钡溶液形成的BaSO3可被稀HNO3氧化为BaSO4
与加入的氯化钡溶液形成的BaSO3可被稀HNO3氧化为BaSO4
②若反应后的固体有Na2O2残留,溶于水后可把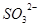 氧化为
氧化为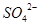 ,最终也可以得到同样的现象
,最终也可以得到同样的现象
正确的检验过程是:先加入过量盐酸,再加入氯化钡溶液,如果有白色沉淀生成,则可证明有Na2SO4存在
(2)CO被Na2O2氧化:Na2O2+CO=Na2CO3
Na2CO3属于碳酸盐,可用酸与其反应产生CO2,再通入澄清石灰水中,看是否有浑浊出现;
由于H2C2O4  ?CO2↑+CO↑+H2O,产生的CO中含有CO2,故应先用碱液吸收CO2,则装置接口的连接顺序为:a b c f
?CO2↑+CO↑+H2O,产生的CO中含有CO2,故应先用碱液吸收CO2,则装置接口的连接顺序为:a b c f
本题难度:一般
3、实验题 用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1) 用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl溶液的pH ?7(填“<”、“=”或“>”),显?性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为?;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为?。
(3) 25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)?。
A.氨水与氯化铵发生化学反应? B.氯化铵溶液水解显酸性,增大了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
参考答案:(1)<?酸? NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(1)H2?(3)C
本题解析:(1)NH4Cl是强酸弱碱盐,NH4+水解显酸性,方程式为NH4++H2O NH3·H2O+H+。
NH3·H2O+H+。
(2)氯化铵显酸性,所以能和镁反应产生氢气。
(3)氨水中存在电离平衡NH3·H2O NH4++OH-。加入少量氯化铵固体,增大NH4+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
NH4++OH-。加入少量氯化铵固体,增大NH4+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
本题难度:一般
4、实验题 (18分)科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性。
(一)学生(甲)应用下图装置(A)所示意的方法研究氯气的性质,其中气体的主要成分是氯气(含有空气和水蒸气)。请回答下列问题:

(1)该项研究(实验)的主要目的是?
(2)浓硫酸的作用是?。与研究目的直接相关的实验现象是? ________________? _?。
(3)虚框中的装置应选择??(填“B”或“C”),其盛放的试剂
为??(填试剂名称);使用该装置的目的是?;该装置内发生反应的化学方程式为??。
(二)学生(乙)设计实验探究金属铝表面氧化膜的性质:将铝片(含氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。回答下列问题:
(1)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是?。
(2)同学(乙)认为:铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因是“氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能”。并设计如下实验方案进行验证,请你根据其思路完成下列空格:
[实验方案] 在硫酸铜溶液中加入铝片,无明显现象,再加入?(填试剂名称),若反应明显加快了,说明上述推断正确。
参考答案:(18分)(一)
(1)比较干燥的氯气和潮湿的氯气的漂白性(或研究氯气的漂白性实验等合理答案均可)(2分)
(2)吸收气体中的水;干燥的有色布条不褪色,湿润的有色布条褪色(合理答案均可)
(各空2分,共4分)
(3)B?;NaOH溶液;防止有毒的Cl2污染空气;2NaOH + Cl2 ="=" NaCl + NaClO+ H2O (各空2分,共8分)
(二)(1)2Al+3Cu2+=3Cu+2Al3+;(2分)
(2)氯化钠(加入盐酸错误)(2分)
本题解析:通过实验设计与探究,研究反应原理及物质的性质
(一)(1)混有水蒸汽的氯气,先通过浓硫酸,得到干燥的氯气;随后氯气分别与干燥、湿润的有色面条接触,很明显是对比实验,比较干燥的、潮湿的氯气的漂白性差异
(2)浓硫酸吸收气体中的水,必然导致干燥的有色面条无变化,但与湿润的有色布条可生成次氯酸,最终导致其褪色
(3)由于氯气有毒,不能直接排放到空气中,而C装置是个密封装置,不正确,故应选择B装置:氯气可被碱液吸收2NaOH + Cl2 ="=" NaCl + NaClO+ H2O
(二)(1)红色物质必须是铝置换出的铜单质:2Al+3Cu2+=3Cu+2Al3+
(2)实验中两盐溶液溶质的差别无所谓就是阴离子的不同,导致了反应现象的不同,故可在硫酸铜溶液中加入铝片,无明显现象后,再加入含有氯离子溶液即可,为了不改变溶液的酸碱性,最好加入氯化钠溶液,再观察现象
本题难度:一般
5、实验题 (12分) 甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:?
?;
(2)丙同学认为乙同学的猜想也不正确,他的理由是?
?。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
实验步骤
| 设计这一步骤的目的
|
1.将配制的氢氧化钠溶液加热??
| ?
|
2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油?
| ?
|
(4)通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,大家能设计实验证明吗?
实验方法
| 可能观察到的现象和结论
|
方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。
| 物质的量浓度大的溶液中酚酞红色消失
证明?
|
方案二:向原红色消失的溶液中加?
(填试剂名称)
| 红色重新出现,则说明红色消失与氢氧化钠物质的量浓度大小有关
参考答案:⑴若酚酞变质,刚开始溶液就不会变红色了。
⑵氢氧化钠溶液与空气中的二氧化碳反应生成碳酸钠和水,碳酸钠水溶液显碱性,红色不会消失。
⑶①除去溶液的氧气?②利用植物油隔绝空气
⑷①红色消失与氢氧化钠的物质的量浓度大小有关?②水
本题解析:本题以实验探究为题材,考查学生的分析问题和解决问题的能力;(1)酚酞遇碱变红色,如果酚酞变质,则开始加入时就不能变成红色,故甲的说法不正确;(2)氢氧化钠与二氧化碳反应后生成碳酸钠溶液,碳酸钠溶液呈碱性,会使酚酞试液变红,故乙的说法也不正确;(3)丙同学先把氢氧化钠加热,是为了排净溶液中溶解的氧气,再加植物油是为了使试液与空气隔绝,防止发生氧化反应;(4)在丁同学的猜想中,如果在不同浓度的氢氧化钠溶液中,物质的量浓度大的溶液里酚酞的红色消失,则证明红色消失与氢氧化钠的物质的量浓度大小有关;若向红色消失的溶液中继续加水,红色重现,则证明其结论是正确的。
本题难度:简单
|