微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (7分)某物质可能含有炭粉、CaCO3、CuO、Fe2O3中的一种或几种。现进行如下实验:
(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体。
(2)往冷却后的固体残渣中加入足量的稀HCl,固体残渣全部溶解,同时产生一种可燃气体。
根据上述实验推断:该物质中一定含有________,一定不含有________,可能含有________。写出有关反应的化学方程式,属于氧化还原反应的,标出电子转移的方向和数目。属于离子反应的,写出离子方程式。
参考答案:C、Fe2O3? CuO? CaCO3
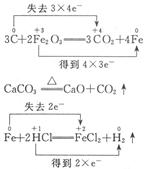
Fe+2H+====Fe2++H2↑
本题解析:能使澄清石灰水变浑浊的气体为CO2,能产生CO2的反应可能为CaCO3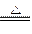 CaO+CO2↑,C+2CuO
CaO+CO2↑,C+2CuO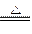 2Cu+CO2↑,2Fe2O3+3C
2Cu+CO2↑,2Fe2O3+3C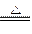 3CO2↑+4Fe。加入盐酸固体全部溶解,说明此物质无C、Cu粉。能产生一种可燃性气体,说明溶于盐酸时发生了如下反应:Fe+2HClFeCl2+H2↑,因此原混合物中肯定有C和Fe2O3,一定不会含有CuO。CaCO3存在与否不能确定。
3CO2↑+4Fe。加入盐酸固体全部溶解,说明此物质无C、Cu粉。能产生一种可燃性气体,说明溶于盐酸时发生了如下反应:Fe+2HClFeCl2+H2↑,因此原混合物中肯定有C和Fe2O3,一定不会含有CuO。CaCO3存在与否不能确定。
本题难度:一般
2、实验题 (16分).某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
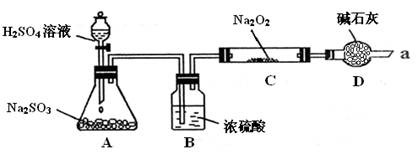
Ⅰ.装置B的作用??。
装置D的作用??。
Ⅱ.如何检验反应中是否有O2生成
??。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:??。
(1)假设2的反应方程式为?。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4。
该方案是否合理?(填“是”或“否”),理由是??。
(3)设计实验验证假设3:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,??,则假设3成立。(写明操作与对应的现象)
参考答案:(16分)Ⅰ.B:干燥SO2气体,防止较多的水蒸气与Na2O2反应………………(2分)
D:防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;同时吸收过量的SO2,以免污染空气。…………………………………………………………………(2分)
Ⅱ.用带用余烬的木条靠近干燥管口a,观察其是否燃烧。…………………(2分)
Ⅲ.有Na2SO3和Na2SO4? ……(2分)?(1)Na2O2 + SO2 = Na2SO4 ……(2分)
(2)否………(1分)? HNO3?有氧化性,可将据SO3?2-氧化成SO42-。……(2分)
(3)先加入过量的稀盐酸,产生剌激性气味气体,再加入适量的BaCl2溶液,又产生白色沉淀。(或先加入过量BaCl2溶液,产生白色沉淀;再加入过量的稀盐酸,白色沉淀部分溶解,并产生剌激性气味气体。)……(3分)
本题解析:
本题考点是:硫元素及其化合物,解题思路可以模仿Na2O2与CO2的反应,但要注意SO2除了是酸性氧化物外,还具有还原性。
制SO2原理:Na2SO3+H2SO4=Na2SO4+SO2↑,装置及作用:A制备SO2,→B干燥SO2→C、Na2O2与SO2反应→D尾气处理
Ⅰ.B:干燥SO2气体,防止较多的水蒸气与Na2O2反应;D:防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;同时吸收过量的SO2,以免污染空气。注意答案要全面;Ⅱ.检验O2,用带用余烬的木条靠近干燥管口a,观察其是否燃烧。Ⅲ.有Na2SO3和Na2SO4(1)Na2O2 + SO2 = Na2SO4(2)检验SO42―不合理, HNO3?有氧化性,可将据SO3?2-氧化成SO42-。
(3)合理的方案是:要排除SO32―的干扰。先加入过量的稀盐酸,产生剌激性气味气体,再加入适量的BaCl2溶液,又产生白色沉淀。(或先加入过量BaCl2溶液,产生白色沉淀;再加入过量的稀盐酸,白色沉淀部分溶解,并产生剌激性气味气体。)
本题难度:简单
3、填空题 (14分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
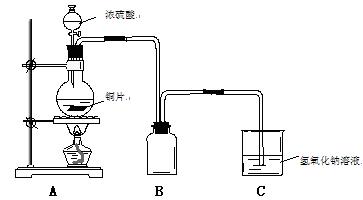
(1). B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2).向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,
①请写出铜跟浓硫酸反应的化学方程式:_____________________________,写出C中发生反应的离子方程式?。
②被还原的H2SO4的物质的量
A 小于0.45摩? B 等于0.45摩
C 在0.45摩与0.90摩之间? D 大于0.90摩
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_______ __ (填写字母编号,有几个写几个,多写或写错0分)。
__ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉
B.BaCl2溶液
C.银粉
D.Na2CO3溶液
 了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。