| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《有关氧化还原反应的计算》在线测试(2017年最新版)(四)
参考答案:C 本题解析:碘化亚铁溶液中存在I—、Fe2+,由于还原性强弱:I—>Fe2+,故缓慢通入3.36 L(标准状况)氯气,Cl2先与I—反应:2I—+ Cl2=I2+2Cl-,再与Fe2+反应:2Fe2++Cl2=2Fe3++2Cl-,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+,故可设原碘化亚铁溶液的物质的量浓度为xmol/L,根据得失电子守恒可知:0.1L×2xmol/L+0.1L×0.5xmol/L=0.3mol,得x=1.2mol·L—1,故C项正确。 本题难度:一般 3、计算题 (15分)用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下: 参考答案:(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为12mol/L 本题解析:(1)根据质量分数与物质的量浓度的换算公式得c=1000×密度×质量分数÷摩尔质量=1000×1.2×36.5%÷36.5=12mol/L。(2)在反应中锰元素化合价降低5价,得到的电子数为2×5,氯元素升高1价,失去的电子数为10×1,标出反应中的得失电子数。(3)反应中高锰酸钾中锰元素化合价降低,故为氧化剂,氯化氢中氯元素化合价升高到氯气,故氯气为氧化产物。(4)根据锰的化合价的变化可以知道,当有xmol KMnO4参加反应,则转移电子的数目为5x mol。(5)15.8g KMnO4为15.8÷158=0.1摩尔,根据反应方程式,完全反应产生Cl20.25摩尔,标准状况下体积为5.6L,同时有0.5 mol HCl被氧化。 本题难度:一般 4、选择题 工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S |
参考答案:
本题解析:
本题难度:一般
5、填空题 按要求完成下列填空:
(1)乙烯发生聚合反应的方程式为:?
(2)苯的硝化反应的化学方程式为:?
(3)乙醇在铜存在条件下催化氧化的方程式为:?
(4)写出CH3C18O16OH与C2H518OH发生酯化反应的方程式::?
(5)写出磁性氧化铁与铝粉发生反应的化学方程式:?
参考答案:(1)nC2H2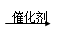 -[-CH2-CH2-]n-
-[-CH2-CH2-]n-
(2)C6H6+HO-NO2 C6H5-NO2+H2O
C6H5-NO2+H2O
(3)2C2H5-OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
(4)CH3C18O16OH与C2H518OH CH3C18O16--18OC2H5+H2O (5)3Fe3O4+8Al
CH3C18O16--18OC2H5+H2O (5)3Fe3O4+8Al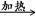 4Al2O3+9Fe
4Al2O3+9Fe
本题解析:(1)乙烯发生加聚反应时断开双键中较活泼的键,然后相互连接形成很长的碳链,不饱和的碳原子变为饱和的碳原子。(2)苯与硝酸在浓硫酸作催化剂的情况下加热/50—60度,发生取代反应产生硝基苯和水。(3)乙醇和氧气在铜存在条件下反应产生为乙醛和水。(4)酯化反应的脱水方式是:酸脱羟基醇脱氢。(5)铝和金属氧化物的混合物在加热时发生铝热反应,铝把金属置换出来。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质的量》试题强.. | |