微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,是非氧化还原反应的是
①H2+C12 2HCl
2HCl
②A12O3+2NaOH=2NaAlO2+H2O
③2HgO 2Hg+O2↑
2Hg+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤MnO2+4HCl MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O
A.②④
B.①③
C.①②③
D.②④⑤
参考答案:A
本题解析:氧化还原反应的判断依据,有无化合价的改变,凡有化合价改变的反应,均属于氧化还原反应。②④反应前后化合价均没变,属于非氧化还原。
本题难度:简单
2、选择题 下列变化中,需加入适当的氧化剂才能完成的是
A.Fe→FeCl2
B.CuO→Cu
C.HNO3→NO
D.SO3→H2SO4
参考答案:A
本题解析:氧化剂在反应中得到电子,元素的化合价降低。还原剂在反应中失去电子,元素的化合价升高,所以如果变化中,需加入适当的氧化剂才能完成,这就说明选项中的微粒是还原剂,有关元素的化合价是升高的。A中铁的化合价升高,需要加入氧化剂。B中铜元素的化合价降低,需要加入还原剂。C中N元素的化合价降低,需要加入还原剂。D中元素的化合价不变,不需要加入氧化剂或还原剂,答案选A。
点评:该题是常识性知识的考查,也是高考中的常见考点。主要是考查学生灵活运用氧化还原反应的有关知识解决实际问题的能力。该题还需要注意的是能够自身发生氧化还原反应的物质,应该具体问题、具体分析。
本题难度:一般
3、选择题 下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是(?)
A.实验室中用稀硫酸与锌粒反应制取 H2
B.实验室中用高锰酸钾加热分解制取 O2
C.实验室中用浓盐酸与二氧化锰加热制取Cl2
D.实验室中用稀盐酸与石灰石反应制取CO2
参考答案:D
本题解析:根据反应前后各元素是否有化合价的升降判断反应是否属于氧化还原反应。
A.B. C.项均有单质生成,均有化合价的变化,属于氧化还原反应;D.稀盐酸与石灰石反应制取CO2没有化合价的变化,不属于氧化还原反应,故选D。
点评:本题考查氧化还原反应,主要考查氧化还原反应的判断,题目较为简单。
本题难度:一般
4、填空题 写出下列反应的化学方程式,并指出氧化剂和还原剂。
(1)锂在空气中燃烧
?
(2)钾与水反应
?
(3)镁条在二氧化碳气体中燃烧
?
(4)曾青得铁则化为铜——湿法炼铜
?
(5)从赤铁矿中提炼铁——工业冶铁
?
参考答案:(10分,每小题2分)
(1) 4Li + O2 = 2Li2O(点燃)?氧化剂:O2?还原剂:Li
(2)2K + 2H2O =" 2KOH" + H2↑?氧化剂:H2O 还原剂:K
(3)2Mg + CO2 =" 2MgO" + C(点燃)?氧化剂:CO2?还原剂:Mg
(4)CuSO4 + Fe = FeSO4 + Cu?氧化剂:CuSO4?还原剂:Fe
(5) Fe2O3 + 3CO =" 2Fe" + 3CO2(高温)?氧化剂:Fe2O3?还原剂:CO
本题解析:凡是有元素化合价升降的反应都是氧化还原反应,在氧化还原反应中失去电子,化合价升高的物质是还原剂。得到电子,化合价降低的物质是氧化剂。据此可知
(1) 4Li + O2 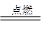 2Li2O?氧化剂:O2?还原剂:Li
2Li2O?氧化剂:O2?还原剂:Li
(2)2K + 2H2O = 2KOH + H2↑?氧化剂:H2O 还原剂:K
(3)2Mg + CO2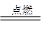 ?2MgO + C?氧化剂:CO2?还原剂:Mg
?2MgO + C?氧化剂:CO2?还原剂:Mg
(4)CuSO4 + Fe = FeSO4 + Cu?氧化剂:CuSO4?还原剂:Fe
(5) Fe2O3 + 3CO 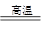 ?2Fe + 3CO2?氧化剂:Fe2O3?还原剂:CO
?2Fe + 3CO2?氧化剂:Fe2O3?还原剂:CO
点评:该题是基础性试题的考查,难度不大,主要是考查学生对常见氧化还原反应方程式书写以及氧化还原反应判断的了解掌握情况,侧重对学生基础知识的巩固和训练,有利于培养学生的规范答题能力,提高学生的学习效率。
本题难度:一般
5、填空题 H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式?,第二步的电离平衡常数表达式Ka2=?。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是?。
①I-?②Fe3+?③Cu2+?④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式:?。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:
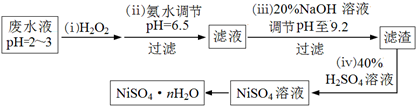
①第(ⅰ)步,加入H2O2反应的离子方程式?。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是?。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为?。
参考答案:(1)H2O2 H+ + HO2-(2分)?
H+ + HO2-(2分)?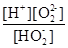 或
或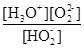 (3分)
(3分)
(2)①④(2分)
(3)O2 + H2O + 2e- = HO2-+ OH- (3分)
(4)①2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O(3分)
②尿糖的检测(2分)
③NiSO4·6H2O (3分)
本题解析:(1)第一步电离,1个H2O2电离出1个H+,电离方程式为:H2O2 H+ + HO2-;第二步电离为:HO2-
H+ + HO2-;第二步电离为:HO2- O22?+H+,所以电离平衡常数Ka2=
O22?+H+,所以电离平衡常数Ka2=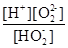 。
。
(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I?、Fe2+具有较强的还原性,故①④正确。
(3)正极为O2得电子,根据总反应方程式,O2中O元素化合价降低转化为HO2-,则正极反应方程式为:O2 + H2O + 2e- = HO2-+ OH-
(4)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O
②第(ⅱ)步,滤渣中的主要成分为Cu(OH)2,在医疗上可用于尿糖的检测。
③根据方程式:Ni2++ H2Y2-=NiY2-+ 2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O
本题难度:一般