微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应2SO2+O2 ?2SO3在一定温度下达到平衡,下列说法正确的是(? )
?2SO3在一定温度下达到平衡,下列说法正确的是(? )
A.增大压强,平衡向右移动,平衡常数K增大
B.此时一定满足c(SO2)=2c(O2)
C.增加O2的浓度平衡向右移动,SO2的转化率增大
D.平衡向右移动时反应物的浓度减小,生成物的浓度增大
参考答案:C
本题解析:平衡常数只与温度有关系,改变压强,平衡常数不变,A不正确;平衡时SO2和氧气的浓度不再发生变化,但二者不一定满足2倍的关系,B不正确;增大氧气的浓度,平衡向正反应方向移动,SO2的转化率增大,C正确;D不正确,平衡向正反应方向移动,反应物的浓度不一定减小,生成物的浓度不一定增大,答案选C。
本题难度:一般
2、选择题 完全相同的两个容器甲和乙,已知甲中装有SO2、O2各1克,乙中装有SO2 O2各2克,在同一温度下反应,2SO2(g)+O2(g)? 2SO3(g)达平衡时,甲中SO2的转化率为a% ,乙中SO2的转化率为b%,则?(?)

A.a% > b%
B.a%< b%
C.a%=" b%"
D.无法判定
参考答案:B
本题解析:建立这样的模型,把乙中的SO2、O2平均分成2份,每份为1克 SO2和 O2,然后,在与甲相同的容器中建立两个完全相同的平衡状态。如:
1g SO2
1g O2
1g SO2
1g O2

2g SO2
2g O2
本题难度:一般
3、选择题 一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
D.X、Y的转化率相等
参考答案:D
本题解析:根据方程式可知,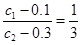 ,解得c1∶c2=1∶3,即二者的起始浓度之比恰好等于相应的化学计量数之比,所以X、Y的转化率相等,A不正确,D正确;反应速率之比是相应的化学计量数之比,所以平衡时,Y和Z的生成速率之比为3∶2,B不正确;如果反应向正反应方向进行,则(c1-0.1)×2=0.08-c3,解得c1<0.14 mol/L。如果反应向逆反应方向进行,则c1只要大于0即可,所以选项C也不正确,答案选D。
,解得c1∶c2=1∶3,即二者的起始浓度之比恰好等于相应的化学计量数之比,所以X、Y的转化率相等,A不正确,D正确;反应速率之比是相应的化学计量数之比,所以平衡时,Y和Z的生成速率之比为3∶2,B不正确;如果反应向正反应方向进行,则(c1-0.1)×2=0.08-c3,解得c1<0.14 mol/L。如果反应向逆反应方向进行,则c1只要大于0即可,所以选项C也不正确,答案选D。
本题难度:一般
4、选择题 把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是
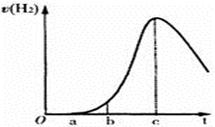
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
参考答案:C
本题解析:金属铝与稀硫酸的反应不是可逆反应,不存在平衡状态,选项C不正确,其余选项都是正确的,答案选C。
本题难度:简单
5、填空题 (5分)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+dD,当反应进行一定时间
cC(s)+dD,当反应进行一定时间 后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
(1)该化学方程式各物质的化学计量数为a=_____、b=______、c=_____、d=______。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为______。
(3)若只升高温度, 反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
参考答案:(5分)(第3问是1分,其它各2分)
(1)2? 1? 3? 2 ?(2)气态?(3)放热
1? 3? 2 ?(2)气态?(3)放热
本题解析:略
本题难度:一般