微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC( 同上)。
同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
|
n(NO2)/mol
| 0.40
| n1
| 0.26
| n3
| n4
|
n(N2O4)/mol
| 0.00
| 0.05
| n2
| 0.08
| 0.08
|
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为?;
②该反应的平衡常数K的值为?;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是?mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为?;(结果保留小数点后一位)
2、选择题 某绝热恒容容器中充入2mol/LNO2,发生反应2NO2 N2O4△H=—56.9kJ/mol下列分析不正确的是
N2O4△H=—56.9kJ/mol下列分析不正确的是
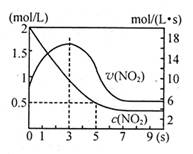
A.5s时NO2的转化率为75%
B.0—3s时v(NO2)增大是由于体系温度升高
C.3s时化学反应处于平衡状态
D.9s时再充入N2O4,平衡后K较第一次平衡时大
3、填空题 A、B、C、D、E均为中学化学常见的10电子粒子。已知,M(A)>M(B),
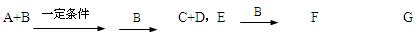
C是一种重要的化工原料。下图表示在1L的密闭容器中,一定条件下X、Y、C三种气体因发生反应而导致的物质的量随时间的变化情况。?

回答下列问题。?
(1)写出B的电子式?。
(2)写出F G的离子方程式?。
G的离子方程式?。
(3)根据题图写出相关的化学方程式?。(用化学式表示)
(4)下表为一定条件下平衡混合物中C的体积分数(C%)。分析数据可知,表中a的取值范围是?。?
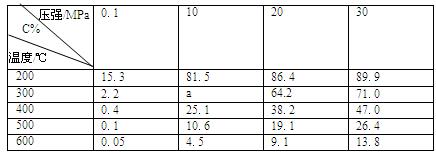 ?
?
(5)根据题图和题表分析,25 min ~ 40 min内曲线发生变化的原因可能是?(填选项代号,下同);50 min ~ 65 min曲线发生变化的原因可能是?。 ?
?
A.降低温度?B.增加C的物质的量? C.加了催化剂?D.缩小容器体积
(6)工业上合成C的温度一般选择在500℃左右,主要原因是?。
4、选择题 已知反应mA(g)+nB(g) qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是
qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是
A.增加A的质量,B的转化率降低
B.降低温度,混合气体的平均相对分子质量变小
C.通入稀有气体压强增大,平衡向正反应方向移动
D.B的正反应速率是A的逆反应速率的n/m
5、选择题 常温常压下,注射器甲中装有NO2气体,注射器乙中装有相同体积的空气,注射器与U 形管连通,如图所示,打开两个止水夹,同时向外拉两注射器的活塞,且拉动的距离相等,将会看到U形管中液面(不考虑此条件下NO2与水的反应)(?)

A.a端上升,b端下降
B.a端下降,b端上升
C.U形管中液面无变化
D.无法判断