微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 部分含硫物质如图1所示,其中H2S和X是大气污染物.这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持.
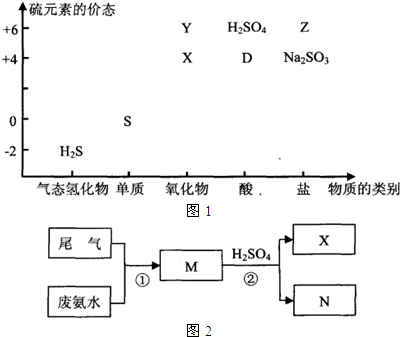
(1)已知Na2SO3可发生下列过程:X
Na2SO3→Z,其中反应①的离子方程式是______.若欲将X转化成“安全物质”Z,使其对环境的影响最小,需加入______(填字母).
a.氧化剂?b.还原剂?c.酸性物质?d.碱性物质
(2)为了减少向大气排放X,不同企业采取不同的措施.
方法一:向含硫煤中加入适量石灰石,可将X转化为含钙的“安全物质”,减少其排放所造成的污染,该过程的化学方程式是______.
方法二:如图2是用废氨水回收含有低浓度X工业尾气的流程示意图.请回答下列问题:
M的化学式是______;
此法处理尾气的优点是______,______.
参考答案:(1)由过程可知,X与碱反应生成亚硫酸钠,则X为二氧化硫,则反应①的离子方程式为SO2+2OH-=SO32-+H2O,X转化成“安全物质”Z,可将其氧化为硫酸根离子或利用碱吸收,应选a或d来实现转化,
故答案为:SO2+2OH-=SO32-+H2O;a、d;
(2)方法一:亚硫酸钙能被空气中的氧气氧化为硫酸钙,该反应为2CaCO3+O2+2SO2?一定条件?.?2CaSO4+2CO2,
故答案为:2CaCO3+O2+2SO2?一定条件?.?2CaSO4+2CO2;
方法二:二氧化硫能被氨水吸收,反应生成亚硫酸铵或亚硫酸氢铵,则M为(NH4)2SO3或NH4HSO3,该方法可得到氮肥,且提高二氧化硫的浓度,
故答案为:(NH4)2SO3或NH4HSO3;制得氮肥;提高SO2的浓度.
本题解析:
本题难度:一般
2、简答题 高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
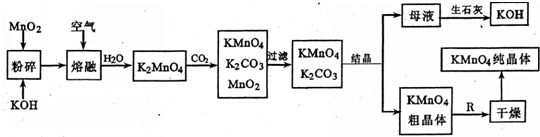
(1)KMn04是______(填颜色)的晶体,其稀溶液是一种常用的消毒剂.其消毒机理与下列______(填序号)物质相似.A.75%酒精?B.双氧水?C.苯酚?D.84消毒液(NaClO溶液)
(2)写出K2Mn04溶液中通入CO2时发生的主要反应的离子方程式______
(3)上述流程图中:①可以循环使用的物质有生石灰、二氧化碳.Mn02和______(写化学式);②KMn04粗晶体变为KMnO4纯晶伴,需经过步骤R,R为______(填实验操作名称).
(4)实际生产中,常用硫酸工业的废气(含S02)与该厂的废水(含KMnO4)按一定比例混合,以减少工业“三废”对环境的污染.写出KMnO4与SO2反应的离子方程式为______
(5)若不考虑物质循环与制备过程中的损失,则1mol?MnO2可制得______mol?KMn04.
参考答案:(1)高锰酸钾晶体是深紫色,KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选:深紫色,BD;
(2)反应中K2MnO4→KMnO4,Mn元素化合价由+6价升高为+7价,共升高变化1价,K2MnO4→MnO2,Mn元素化合价由+6价降低为+4价,共降低2价,化合价升降最小公倍数为2,故KMnO4系数为2,MnO2系数为1.根据Mn元素守恒可知KMnO4系数为3,
根据K元素守恒可知K2C03系数为2,由碳元素守恒可知系数C02为2,方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
故答案为:3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
(3)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,故答案为:KOH;
(4)二氧化硫具有还原性和KMnO4在水溶液中发生氧化还原反应,生成硫酸和硫酸锰,依据氧化还原反应电子守恒和原子守恒配平得到,5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(5)最初的原料中1mol MnO2恰好得到1mol KMnO4.由3K2MnO4+CO2=2KMnO4+K2CO3+MnO2知,1mol K2MnO4在反应中能得到23molKMnO4,即0.67mol;
故答案为:23,或0.67mol;
本题解析:
本题难度:一般
3、填空题 Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(1)浓盐酸在反应中显示出来的性质是______?(填写字母)
A.只有还原性?B.还原性和酸性?C.只有氧化性?D.氧化性和酸性
(2)产生0.3molCl2,则转移的电子的物质的量为______
(3)该反应中氧化产物与还原产物的质量比为______
(4)用双线桥法表示该氧化还原反应中电子转移的方向和数目______.
参考答案:(1)该反应中,浓盐酸中的氯元素部分失去电子作还原剂,部分化合价不变,作酸,所以浓盐酸的性质是还原性和酸性,故选B;
(2)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以生成2mol氯气时其转移电子是2mol,故产生0.3molCl2,则转移的电子的物质的量为0.3mol,
故答案为:0.3mol;
(3)该反应中,次氯酸钙得电子作氧化剂,盐酸失电子作还原剂,其对应的产物都是氯气,得失电子数相等时,生成氧化产物和还原产物的氯气的物质的量相等,所以其质量之比是1:1,故答案为1:1;
(4)该反应中,1mol次氯酸钙反应得到2mol电子,生成1mol氯气,盐酸失去2mol电子需要2mol盐酸作还原剂,生成1mol氯气,所以其转移电子数是2,

,
故答案为:

.
本题解析:
本题难度:一般
4、简答题 中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是______,该反应的化学方程式是______.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是______.
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是______.
②含a?mol?X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______?mol.
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是______.
参考答案:(1)因黄绿色气体为氯气,氯原子最外层7个电子,则氯气中存在一对共用电子对,其电子式为
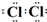
,A、B的物质的量之比为1:4,
则反应为MnO2+4HCl(浓)?△?.??MnCl2+Cl2↑+2H2O,故答案为:
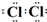
;MnO2+4HCl(浓)?△?.??MnCl2+Cl2↑+2H2O;
(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,其质子数等于电子数等于6,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,其反应为C+4HNO3═CO2↑+NO2↑+H2O,由化合价可知碳元素的化合价升高,则碳作还原剂,硝酸中氮元素的化合价降低,则硝酸作氧化剂,由化学计量数可知氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1;?
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;
①铁为26号元素,在在元素周期表中的第4周期Ⅷ族,铁与稀硝酸反应生成的Y为NO,故答案为:第4周期Ⅷ族;NO;
②设被还原的硝酸铁的物质的量为x,则
2Fe3++Fe═3Fe2+,
?2? 3
?x? 3x2
由溶液中两种金属阳离子的物质的量恰好相等,则a-x=3x2,解得x=0.4a,故答案为:0.4a;
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有钠元素,A与B按物质的量之比1:4恰好反应,则该反应为氯化铝与氢氧化钠的反应,其反应为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,显然若A与B的物质的量分别为1mol、4mol,则钠离子4mol,氯离子3mol,偏绿酸根离子略小于1mol,因偏铝酸根离子水解则溶液显碱性,即c(OH-)>c(H+),则离子大小为c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+).
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是( )
A.氧化剂是失去电子(或电子对偏向)的物质
B.还原剂是在反应中发生还原反应
C.同一反应中,既有单质参加,又有单质生成的反应一定是氧化还原反应
D.依据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
参考答案:A.氧化剂是得电子(或电子对偏向)的反应物,还原剂是失电子(或电子对偏离)的反应物,故A错误;
B.还原剂在反应中失电子发生氧化反应,故B错误;
C.同一反应中,既有单质参加,又有单质生成的反应不一定发生氧化还原反应,如臭氧和氧气之间的转化,故C错误;
D.有电子转移的化学反应是氧化还原反应,其特征是有元素化合价变化,故D正确;
故选:D.
本题解析:
本题难度:一般