微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.

 ?(1)写出该反应配平的化学方程式:?
?(1)写出该反应配平的化学方程式:?
 ?(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为?。
?(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为?。
 ?(3)阿伏加德罗数常数为(用含a、b的代数式表示)?。
?(3)阿伏加德罗数常数为(用含a、b的代数式表示)?。
参考答案:(1)8NH3+3Cl2?6NH4Cl+N2(2)3:2 (3)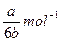
本题解析:根据电子转移守恒,配平的化学方程式8NH3+3Cl2?6NH4Cl+N2,根据化学方程式可知NH3为还原剂,Cl2为氧化剂,参加氧化还原反应的氧化剂和还原剂的物质的量之比为3:2.
本题难度:一般
2、计算题 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算:
(1)生成标准状况下的H2多少升?
(2)所得溶液中硫酸锌的物质的量浓度。
参考答案:2.24L;(2)1.25mol·L-1(每项3分,格式、单位不正确的酌情扣分1-2分)。
本题解析:(1)6.5g锌的物质的量是6.5g÷65g/mol=0.1mol
Zn?+? H2SO4=ZnSO4?+? H2↑
1mol? 1mol? 22.4L
0.1mol? 0.1mol? 2.24L
即生成的氢气在标准状况下的体积是2.24L
(2)硫酸锌的物质的量是0.1mol
所以硫酸锌的物质的量浓度是0.1mol÷0.08L=1.25mol/L
点评:该题是高考中的常见题型和考点,属于基础性试题的考查。试题基础性强,侧重学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和规范答题能力。该题的关键是明确反应原理和物质的量浓度概念,然后借助于方程式直接列式计算即可。
本题难度:一般
3、选择题 a mol FeS与b mol FeO投入到VL、c mol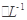 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(? )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(? )
①(a+b)x63g?②(a+b)x189g?③(a+b)mol?④(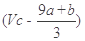 )mol
)mol
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析:第一种情况:硝酸有剩余。由电子守恒知:a mol FeS与b mol FeO:→Fe(NO3)3和H2SO4,共转移的电子的物质的量 (9a+b) mol,所以被还原的硝酸是(9a+b)/3 mol,则未被还原的硝酸为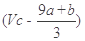 ?mol;第二种情况:硝酸恰好完全反应生成NO和Fe(NO3)3,则未被还原的硝酸的物质的量是3(a+b) mol,质量(a+b)x189g。所以D正确。
?mol;第二种情况:硝酸恰好完全反应生成NO和Fe(NO3)3,则未被还原的硝酸的物质的量是3(a+b) mol,质量(a+b)x189g。所以D正确。
本题难度:一般
4、填空题 臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)=4Ag(s)+O2(g)? ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)=3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):
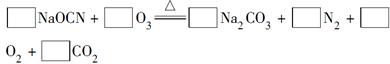 ?
?
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
参考答案:(1)-285.0 kJ·mol-1
(2)2 3 1 1 3 1
(3)3O2+6H++6e-=3H2O2(或O2+2H++2e-=H2O2)
(4)2I-+O3+H2O=2OH-+I2+O2
本题解析:(1)由盖斯定律可得2O3(g)=3O2(g)
ΔH=-285.0 kJ·mol-1。(2)O3~2e-~O2-,2NaOCN~6e-~N2,根据得失电子守恒有2NaOCN~6e-~3O3,再根据原子守恒配平即可。(3)阴极发生还原反应,在酸性条件下,氧气得电子结合氢离子形成H2O2。(4)根据生成两种单质可知,O3将KI氧化为I2,同时O3被还原为O2,由O3~2e-~O2-,2KI~2e-~I2,可得2KI~2e-~O3,再根据原子守恒配平即可。
本题难度:一般
5、填空题 (1)配平氧化还原反应方程式
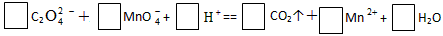
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为__________mol。
②第二份溶液滴加0.10 mol/L 酸性KMnO4溶液至16mL时反应完全,此时溶液颜色,由__________变为
___________。该溶液中还原剂的物质的量________mol。
③原试样中H2C2O4·2H2O的质量分数为_________,KHC2O4的质量分数为___________。
参考答案:(1)5、2、16、10、2、8
(2)①0.005;②无色;紫红色;0.004;③21%;64%
本题解析:
本题难度:一般