微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)(1)二氧化硫的催化氧化的过程如图所示,

其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4?
SO3+ V2O4?
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是?(写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
压强/MPa
温度/℃
| 0.1[
| 0.5
| 1
| 10
|
400
| 99.2%
| 99.6%
| 99.7%
| 99.9%
|
500
| 93.5%
| 96.9%
| 97.8%
| 99.3%
|
600
| 73.7%
| 85.8%
| 89.5%
| 96.4%
|
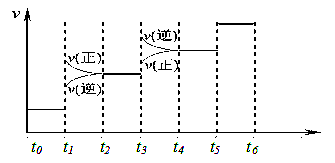
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图所示。图中t1 时引起平衡移动的条件可能是?其中表示平衡混合物中SO3的含量最高的一段时间是?。
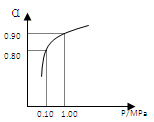
(3)550?℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5?L密闭容器中,反应达平衡后,体系总压强为0.10 M?Pa。试计算反应2SO3 2SO2+O2?在550?℃时的平衡常数K=?。
2SO2+O2?在550?℃时的平衡常数K=?。
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是?
A.升高温度? B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2?D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+)?2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数?。
2、选择题 在N2+3H2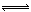 2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,此时下列叙述正确的是
2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,此时下列叙述正确的是
A.正反应速率和逆反应速率均增大,平衡向正反应方向移动
B.正反应速率和逆反应速率都没有变化,平衡也不移动
C.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
D.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
3、计算题 加热N2O5,依次发生的分解反应为 ①N2O5(g) N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g) N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
4、选择题 某温度下,在密闭容器中存在下列可逆反应:A(g)+2B(g)  ?
? ?4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
?4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
A.若为恒容容器,当a∶b∶c为2∶2∶1时,平衡不移动
B.若为恒容容器,当a∶b =9∶10,且c=0时,达平衡后,A、B、C物质的量之比仍为2∶2∶1
C.若为恒压容器,当a∶b为9∶10,c为任意值时,平衡后A的质量分数一定仍为w%
D.若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质 量分数小于w%
量分数小于w%
5、选择题 下列理解不正确的是( )。
A.化学平衡是一个动态平衡
B.化学平衡研究的对象主要是可逆反应
C.化学反应速率是研究化学反应进行的快慢问题,化学平衡是研究化学反应进行的限度问题
D.化学反应达到平衡时,正反应和逆反应速率相等,是对反应中不同物质而言