微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯气是一种化学性质很活泼的非金属单质,下列叙述中不正确的是( )
A.通常状况下,干燥的氯气能和Fe反应
B.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸
D.实验室制取氯气时,将所得气体依次通入盛有浓硫酸和饱和食盐水的洗气瓶可得纯净干燥的氯气
参考答案:A.干燥的氯气能和Fe反应,反应条件为点燃或加热,故A错误;
B.氯气与铜反应生成氯化铜固体,观察到产生棕黄色的烟,故B正确;
C.氢气与氯气反应生成HCl,HCl极易结合空气中的水蒸气,点燃时安静燃烧发出苍白色火焰,集气瓶口呈现雾状,光照下反应快发生爆炸,故C正确;
D.制取氯气时,浓盐酸易挥发,则除去氯气中的HCl,则先通过饱和食盐水,即气体依次通入盛有饱和食盐水和浓硫酸的洗气瓶可得纯净干燥的氯气,故D错误;
故选AD.
本题解析:
本题难度:简单
2、填空题 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下:
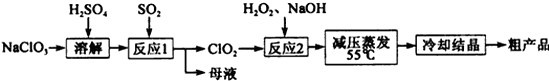
(1)提高“反应1”反应速率的措施有?。(回答一点即可)
(2)“反应1” 的离子方程式是?。?
(3)“反应2”的氧化剂是?,该反应的化学方程式为?。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是?。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1?Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为?。?
②该样品中NaClO2的质量分数为? (用含m、c、V的代数式表示,结果化成最简。)
参考答案:(1)适当升高反应温度,增大吸收液浓度,增大SO2与吸收液的接触面积
(2)2ClO3- + SO2 =2ClO2 + SO42-
(3)ClO2? H2O2 + 2ClO2 + 2NaOH=2NaClO2 + 2H2O + O2
(4)常压蒸发温度过高,亚氯酸钠容易分解
(5)①滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色
② %
%
本题解析:(1)反应1是SO2气体与溶液的反应,根据反应速率增大的原理,可以是适当升高反应温度,增大吸收液浓度,增大SO2与吸收液的接触面积;气体加压会影响成本,一般不使用;反应较快不再使用催化剂。
(2)流程看出ClO3-→ClO2,Cl元素化合价降低,故氧化反应是SO2→SO42-。
(3)反应2是将ClO2→NaClO2,Cl元素化合价降低,故ClO2是氧化剂,H2O2是还原剂,其中H2O2中的-1价O变成O2。
(4)减压是为了降低物质的沸点,即降低蒸发温度,发展物质分解。
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色。②由反应中的I元素守恒可知:
ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)= 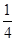 ×cV×10-3mol,m(NaClO2)=
×cV×10-3mol,m(NaClO2)= 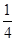 ×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为
×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为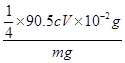 ×100%=
×100%= %。
%。
本题难度:困难
3、选择题 向某盐溶液中通入过量Cl2无明显现象,滴加Ba(NO3)2溶液和稀HNO3后,有白色沉淀生成,则原溶液可能是( )
A.AgNO3溶液
B.CaCl2溶液
C.Na2SO3溶液
D.Na2CO3溶液
参考答案:C
本题解析:A错。硝酸银溶液中能入氯气有氯化银白色沉淀生成;B错,均无现旬;C正确,有硫酸钡沉淀产生;D错,通入过量氯气有气体生成,再滴加硝酸钡溶液无沉淀生成;
本题难度:简单
4、选择题 自来水厂常用氯气作消毒剂,用自来水配制下列物质的溶液,其中不会发生明显变质的是( )
①AgNO3?②FeCl2?③Na2CO3?④KI?⑤NaOH?⑥AlCl3?⑦FeCl3.
A.①⑤
B.⑥⑦
C.②③
D.④⑤
参考答案:氯气微溶于水,氯气与发生反应:Cl2+H2O=Cl-+H++HClO,自来水中含有Cl-、H+、ClO-、HClO、Cl2等粒子,
其中Cl-易与AgNO3反应产生AgCl沉淀而变质,
H+易与Na2CO3、NaOH等发生反应而使溶液变质,
ClO-、HClO、Cl2等离子具有强氧化性,易氧化FeCl2、KI等物质而使溶液变质,
自来水配制下列物质的溶液,不会发生明显变质的只有⑥AlCl3、⑦FeCl3,
故选B.
本题解析:
本题难度:简单
5、选择题 下列有关氯气的说法中正确的是(? )
A.氯气的水溶液能导电,所以氯气是电解质
B.干燥的氯气无漂白性,液氯具有极强的漂白性
C.氯气能使品红溶液褪色,且受热后溶液的红色不能恢复
D.可用湿润的蓝色石蕊试纸来鉴别氯气中是否含有氯化氢
参考答案:C
本题解析:氯气是单质,不属于电解质,其水溶液能导电是因为氯气与水反应生成了电解质,A错;干燥的氯气和液氯都无漂白性,B错;氯气与水反应生成的次氯酸将品红氧化而导致溶液褪色,该过程不可逆转,C正确;由于Cl2能使湿润的蓝色石蕊试纸先变红后褪色,故不能检验其中是否含有氯化氢,D错
本题难度:一般