微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表是元素周期表的一部分,请回答有关问题:
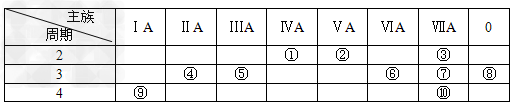
(1)?表中化学性质最不活泼的元素,其原子结构示意图为________________。
(2)?表中能形成两性氢氧化物的元素是________(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式________________________________________。
(3)?①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为___________________________(用化学式表示)。
(4)?③元素与⑩元素两者核电荷数之差是_____________________________。
(5)?请写出②的氢化物发生催化氧化的化学方程式___________________________________。
(6)?请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式___________________________________。
2、选择题 关于图中各装置的叙述不正确的是( )

A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③的实验可推断硫、碳、硅三种元素的非金属性强弱
D.装置④可检验溴乙烷发生消去反应得到的气体中含有乙烯
3、填空题 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素.选用的试剂如下:镁条、铝条、铝粉、钠、新制Na2S溶液、新制氯水、0.5mol?L-1盐酸、3mol?L-1盐酸、酚酞试液;其设计的实验方案及部分实验现象如下表:
| 实验步骤 | 实验现象
①将一小块金属钠投入滴有酚酞试液的冷水中
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色
②将表面积大致相同的镁条和铝条(均已用砂纸打磨过)分别投入足量的相同体积0.5mo1?L-1盐酸中
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快
③将新制氯水滴加到新制的Na2S溶液中
④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol?L-1盐酸和3mol?L-1盐酸中
剧烈反应产生气体,但铝粉消失比镁条快
|
请回答下列问题:
(1)实验①中可以说明该反应是放热反应的现象是______
(2)由实验②可得出决定化学反应快慢的主要因素是______
(3)实验③的现象是产生浅黄色沉淀,离子方程式为______
由实验③可以得出非金属性氯______硫(填“强于”、“弱于”、“无法比较”).
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确?______(填“是”或“否”),通过实验④说明要加快化学反应速率可采取的措施可以是______或______.
4、选择题 下列叙述正确的是( ? )
A.HBr分子的电子式为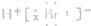
B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
D.熔点由高到低的顺序是;金刚石>碳化硅>晶体硅
5、推断题 已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为
A:B:C=4:2:3。请回答下列问题:
(1)写出B的原子结构示意图_________,写出C和D形成的淡黄色固体化合物的电子式____________。
(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为__________________。
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例)_________、_________。
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式_________。