微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设阿伏加德罗常数为NA,下列叙述中正确的是
A.1 mol 18O2所含质子数为16NA
B.10 g氖气所含原子数为0.5NA
C.0.5 mol Al和足量烧碱反应转移的电子数为1.5NA
D.标准状况下11.2 L SO3所含分子数为0.5NA
参考答案:AC
本题解析:18O为8质子10中子原子,故1 mol 18O2所含质子数为16 mol,即16NA;10 g Ne为1 mol,故其原子数应为NA;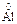 在与NaOH充分反应后转化为Na
在与NaOH充分反应后转化为Na O2,即1 mol Al可失去3 mol电子,故0.5 mol Al可失去的电子数为1.5NA;在标准状况下SO3为固体,11.2 L SO3的物质的量远大于0.5 mol。
O2,即1 mol Al可失去3 mol电子,故0.5 mol Al可失去的电子数为1.5NA;在标准状况下SO3为固体,11.2 L SO3的物质的量远大于0.5 mol。
本题难度:一般
2、计算题 配制250mL 1.0mol·L-1H2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/cm3)体积为多少?取25 mL 1.0 mol·L-1H2SO4溶液与足量的锌反应,在标准状况下产生多少升H2?求硫酸锌的物质的量?
参考答案:(10分)13.59mL(4分)? 0.56L(3分)? 0.025mol (3分)
本题解析:考查物质的量的有关计算。
250mL 1.0mol·L-1H2SO4溶液中溶质的物质的量是0.25L×1.0mol/L=0.25mol
其质量是0.25mol×98g/mol=24.5g
浓硫酸的质量分数是98%
所以需要浓硫酸的质量是24.5g÷0.98=25g
又因为浓硫酸的密度是1.84g/ml
所以需要浓硫酸的体积是25g÷1.84g/ml=13.59ml
25 mL 1.0 mol·L-1H2SO4溶液中硫酸的物质的量是0.025mol×1.0mol/L=0.025mol
根据反应的方程式可知
H2SO4+Zn=ZnSO4+H2↑
1mol? 1mol? 1mol
0.025mol? 0.025mol? 0.025mol
即生成氢气互为硫酸锌都是0.025mol
所以氢气在标准状况下的体积是
0.025mol×22.4L/mol=0.56L
本题难度:一般
3、选择题 向某碳酸钠溶液中逐滴加1 mol·L─1的盐酸,测得溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法中正确的是 (? )
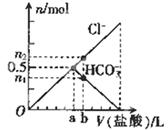
A.Oa段反应的离子方程式与ab段反应的离子方程式相同
B.该碳酸钠溶液中含有1mol Na2CO3
C.b点的数值为0.6
D.b点时生成CO2的物质的量为0.3 mol
参考答案:C
本题解析:注意审题,向某碳酸钠溶液中逐滴加的盐酸,考虑到应该有以下两个依次进行的反应:Na2CO3+HCl=NaCl+Na HCO3①;Na HCO3+HCl=NaCl+H2O+CO2↑②。再分析溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系图,可见Cl─的量一直在增加,而HCO3─开始和Cl─的量增加相同,到加入aml盐酸时HCO3─的量随着盐酸的加入在减少,说明这时开始发生反应②,所以A错误。加入aml盐酸时,此时溶液中Na2CO3恰好反应完,从图中可知物质的量Cl─= HCO3─=0.5mol,由反应①可知Na2CO3的物质的量应为0.5mol,所以B错误。再接着分析加入bml盐酸时,物质的量Cl─: HCO3─=3:2,由反应②可知道增加了0.1molCl─就会减少0.1mol的HCO3─,所以此时n(Cl─)=0.6mol,n(HCO3─)=0.4mol,所以此时加入盐酸的体积为0.6L,C正确。由反应②可计算反应0.1mol的HCO3─应该生成0.1mol的CO2气体,所以D错误。
其中n2:n1=3:2,
点评:熟记碳酸盐和盐酸的分步反应,再依据题意具体分析,此类属于中等难度题型。
本题难度:一般
4、选择题 实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是
[? ]
A.1000mL,212g
B.950mL,543.4g
C.任意规格,572g
D.500mL,286g
参考答案:A
本题解析:
本题难度:简单
5、选择题 标准状况下,11.2升二氧化碳气体的质量是 ( )
A.11克
B.22克
C.44克
D.5.6克