微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制物质的量浓度的溶液,造成浓度偏高的操作是( )
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
参考答案:A、定容时,滴加蒸馏水超过刻度线,溶液的体积偏大,浓度偏小,故A错误;
B、定容时,眼睛俯视刻度线,溶液的液面未达到刻度线,溶液的体积偏小,浓度偏大,故B正确;
C、洗涤烧杯和玻璃棒的溶液未转入容量瓶中,洗涤液中含有杂质,溶质的质量偏小,浓度偏小,故C错误;
D、定容时,眼睛仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,浓度偏小,故D正确;
故选:B.
本题解析:
本题难度:一般
2、简答题 (1)0.5mol?H2O的质量为______,其中共含有______个原子.
(2)质量都是50g的?HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______(填分子式,下同),在相同温度和相同压强条件下,体积最大的是______.
(3)在______mL?0.2mol/L?NaOH溶液中含1g溶质;配制50mL?0.2mol/L?CuSO4溶液,需要CuSO4?5H2O______g.
参考答案:(1)m(H2O)=0.5mol×18g/mol=9g,共含有原子数为:N=3×0.5×NA=9.01×1023,故答案为:9g;9.01×1023;
(2)已知:M(HCl)=36.5g/mol,M(NH3)=17g/mol,M(CO2)=44g/mol,M(O2)=32g/mol,
由n=mM=NNA=VVm可知,相同质量时,摩尔质量越大,气体的物质的量越小,体积越小,则
含有分子数目最少的是CO2,在相同温度和相同压强条件下,体积最大的是NH3,
故答案为:CO2;NH3;
(3)n(NaOH)=1g40g/mol=0.025mol,
V×0.2mol/L=0.025mol,
V=0.125L,即125ml,
n(?CuSO4)=0.05L×0.2mol/L=0.01mol,
m(CuSO4?5H2O )=0.01mol×250g/mol=2.5g,
故答案为:125;2.5.
本题解析:
本题难度:一般
3、选择题 某人排出的尿中含有2%的尿素[CO(NH2)2],如不考虑其他成分,则该人尿中氮元素的质量分数为( )
A.2%
B.9.3%
C.0.93%
D.0.093%
参考答案:C
本题解析:
本题难度:简单
4、填空题 (10分)
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是?。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是_______。(填序号)
①NaAlO2 ?② Ca(OH)2?③Na2CO3?④Al(OH)3
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是
?;过一会儿,溶液颜色逐渐褪去,起作用的成分是?;?
(4)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式?。
参考答案:(1) H2?(2)④?(3)HCl或H+、HClO
(4)5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2
本题解析:(1)质量相同的O2、NH3、H2、Cl2四种气体中,由V=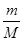 ×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,即氢气。
(2)物质中即与酸反应又与碱反应的主要有:特殊的单质(Al、Zn、Cl2、S、Si 等)、两性化合物(ZnO、AI2O3、Al(OH)3等)、弱酸的酸式盐(NaHS、NaHCO3等)、弱酸的铵盐(NH4)2CO3等)、部分化合物(SO2、NO2等)、氨基酸。
(3)氯水溶液中存在反应:Cl2+H2O?HCl+HClO,是可逆反应,存在电离:H2O H++OH-、HClO
H++OH-、HClO H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
H++ClO-,HCl═H++Cl-,所以溶液中存在的微粒有:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-。酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子。
(4)将a mol Cl2通入含b mol FeBr2的溶液中,还原性Fe2+>Br―,所以通入氯气,Fe2+先被氯气氧化,反应完后再通氯气,Br―被氧化。所以当0< a / b≤1/2时,只有Fe2+被氧化,所以发生反应2Fe2++Cl2 =2Fe3++2Cl-;当 a / b =1时,Fe2+全部被氧化,Br―是Fe2+的2倍,只有1半被氧化,所以发生的反应方程式为2Cl2+2Fe2++2Br―=?2Fe3++Br2+4Cl―;当a / b≥3/2时,Fe2+、Br―全部被氧化,所以反应为3Cl2+2Fe2++4Br―=2Fe3++2Br2+6Cl―。标准状况下把11.2L氯气物质的量是0.5mol,500ml0.8mol/LFeBr2物质的量是0.4mol,氯气与FeBr2的物质的量比是5:4,介于1/2和3/2之间,Fe2+全部被氧化,Br―有剩余所以氯气与Fe2+全部反应完,得5Cl2+4Fe2++Br― ?Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
?Fe3++Br2+Cl―,根据电荷守恒和原子守恒既得5Cl2+4Fe2++6Br―=10Cl-+4Fe3++3Br2。
本题难度:一般
5、选择题 用NA代表阿伏伽德罗常数。下列说法正确的是
A.1molNH3中含有3NA对电子对
B.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5NA
C.将2 mol SO2和1 molO2混合在V2O5存在条件下的密闭容器中,充分反应后分子总数等于2 NA
D.VLa mol·L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
参考答案:B
本题解析:A 错误,1molNH3中含有4NA对电子对
B 错误,每转移1mol电子,阳极上溶解的铜原子数不一定为0.5NA,因为是粗铜,比铜活泼的金属先失去电子。
C 错误,此反应是可逆反应,反应不彻底,得不到2mol SO3
D 正确,Fe3+水解,Cl-的浓度大于三倍的Fe3+浓度。
本题难度:一般