微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请回答下列问题:
(1)A的化学式为?,丙的化学式为?;
(2)写出下列反应的离子方程式:
①?;④ ?;⑤ ?。
(3)写出C溶液与Al反应的化学方程式:
(4)将C溶液加到E溶液中,可以观察到的现象是:
参考答案:(1)A的化学式为? Na?,丙的化学式为? HCl?;
(2)写出下列反应的离子方程式:
①2Na+2H2O=2Na++2OH-+H2↑
④ 2Fe2++Cl2=2Fe3++2Cl-
⑤ Fe3++3OH-= Fe(OH)3
(3)写出C溶液与Al反应的化学方程式:2Al+2NaOH+ 2H2O="2Na" AlO2+3H2↑
(4)将C溶液加到E溶液中,可以观察到的现象是:?产生白色沉淀,迅速变为灰绿色,最后 变为红褐色?
本题解析:略
本题难度:简单
2、填空题 已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
粒子代码
| a
| I
| e
|
原子核数
| 单核
| 四核
| 双核
|
粒子的电荷数
| 一个单位正电荷
| 0
| 一个单位负电荷
|
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:

请填写下列空白:?
(1)写出下列物质的化学式:B??J?。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M?。?②I溶于G ?。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为?。
参考答案:(1)Cl2 ;NO? (2) ①H+ +ClO-= HClO
(3)NH3+H2O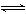 NH3·H2O
NH3·H2O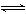 NH4++OH-
NH4++OH-
(4)2HCl(g)=H2(g)+Cl2(g);△H=" +184.6" kJ·mol-1
本题解析:根据a、I、e的结构特点可知a是钠离子,I是氨气,e是OH-,所以A是氢氧化钠。电解能够生成氢氧化钠的是电解饱和的食盐水,即B是氯气,C是氢气,H是氯化氢,则M水次氯酸,所以E是次氯酸盐。次氯酸分解生成氧气和氯化氢。I是氨气,所以D是氮气,氨气催化氧化生成NO和水,所以K是氧气,J是NO,G是水,因此F是氯化钠。
本题难度:一般
3、简答题 A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性.下述为相关实验步骤和实验现象:

请回答:
(1)写出A、B和C的化学式:A______,B______,C______;
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:______,______;
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:______;
(4)写出由F→H的化学方程式:______.
参考答案:钠盐A能和AgNO3溶液反应生成一种难溶于HNO3的黄色沉淀,可确定A为NaI,C为AgI;黄绿色气体F是Cl2;F和NaOH溶液反应生成钠盐B,根据B呈碱性并具有氧化性,可知B为NaClO(NaCl、NaClO3溶液均呈中性);NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,进一步反应生成NaIO3,其中I为+5价;Cl2氧化FeCl2生成FeCl3,FeCl3又能氧化SO2生成SO42-,则
(1)由以上分析可知A为NaI,B为NaClO,C为AgI,故答案为:NaI;?NaClO;?AgI;
(2)NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-,
进一步反应可把I2氧化为NaIO3,反应的离子方程式为I2+5ClO-+2OH-=2IO3-+5Cl-+H2O,
故答案为:2I-+ClO-+H2O=I2+Cl-+2OH-;?I2+5ClO-+2OH-=2IO3-+5Cl-+H2O;
(3)FeCl3能氧化SO2生成SO42-,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)F→H为Cl2与NaOH的反应,反应的方程式为Cl2+2NaOH=NaClO+NaCl+H2O,故答案为:Cl2+2NaOH=NaClO+NaCl+H2O.
本题解析:
本题难度:一般
4、选择题 已 知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是(? )
知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是(? )

A.C和O2
B.SO2 和NaOH溶液
C.Cl2和Fe
D.AlCl3溶液和NaOH溶液
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (15分)钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减小环境污染。请填写下列空白:

(1)电解饱和食盐水时,该反应的离子方程式是____________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);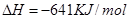
②

则 ____________
____________
反应:

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________
(3)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式______________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时正极区溶液的PH_____(填“增大”、“减小”或“不变”)该电池中负极上的电极反应是__________.
(5)在上述产业链中合成96t甲醇理论上消耗H2_________t(不考虑生产过程中物质的任何损失)
参考答案:(1)(2分)2Cl-+2H2O  Cl2↑+H2↑+2OH-?
Cl2↑+H2↑+2OH-?
(2)-512 KJ/mol (2分)
Mg和Ti都有较强还原性,在高温下都易与空气中的O2反应(2分)
(3)2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO(3分)
2FeCl3+2TiCl4+6CO(3分)
(4)增大(2分)? CH3OH-6e-+8OH-=CO32-+6H2O(2分)?(5)12?(2分)
本题解析::(1)电解食盐水生成NaOH、H2和Cl2,
利用盖斯定律2①-②即可计算出反应热为-512 KJ/mol。由于Mg和Ti都有较强还原性,在高温下都易与空气中的O2反应,所以反应要在Ar气氛中进行。
(3在碱性环境中正极: O2 + 4e- + 2H2O= 4OH- ,所以正极附近的碱性增强。负极甲醇发生氧化反应,CH3OH-6e-+8OH-=CO32-+6H2O
(5)CO(g)+2H2(g)←→ CH3OH(g)
4?32
X? 96t
x="12" t
点评:本题以学生不熟悉的金属钛(Ti)为题眼,结合化学工艺,考查的知识面广,但是设计的知识点简单。注重对基础知识点的考查。
本题难度:一般