微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列比较,不正确的是
A.稳定性HCl>HBr>HI
B.酸性 HClO4>H2SO4 >H2CO3
C.粒子半径 S2-<Cl-<K+<Ca2+
D.沸点 I2>Br2>Cl2>F2
参考答案:C
本题解析:对于核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以选项C中粒子半径应该是S2->Cl->K+>Ca2+,C不正确,其余都是正确的,答案选C。
本题难度:简单
2、填空题 (8分)
(1)地壳中含量最多的元素基态原子核外未成对电子数为?个。
(2)H2O分子内的O-H键、分子间的范德华力和分子间氢键从强到弱依次为?。邻羟基苯甲醛比对羟基苯甲醛的沸点?(填“低”或“高”),其原因为?。
(3)H+可与H2O形成H3O+,H3O+原子采用?杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为?。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3 ,NA表示阿伏伽德罗常数,则C aO晶胞体积为?cm3
aO晶胞体积为?cm3
参考答案:

本题解析:略
本题难度:一般
3、计算题 现有0.2mol某元素 R的单质与足量的盐酸反应,在标准状况下生成6.72LH2。等量的R元素的单质与足量氧气化合,生成10.2gR元素的最高价氧化物。求R的相对原子质量及在元素周期表中的位置。
R的单质与足量的盐酸反应,在标准状况下生成6.72LH2。等量的R元素的单质与足量氧气化合,生成10.2gR元素的最高价氧化物。求R的相对原子质量及在元素周期表中的位置。
参考答案: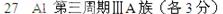
本题解析:略
本题难度:一般
4、选择题 下列关于元素的叙述正确的是(?)
A.只有金属与非金属元素才能形成离子化合物
B.质子数与核外电子数相等的微粒一定是原子
C.简单离子最外层电子数只能是2或8
D.元素周期表中共有18列,分为16个族
参考答案:D
本题解析:A错,如铵盐均由非金属元素组成;B错,如分子;C错,如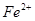 离子;D正确;
离子;D正确;
本题难度:简单
5、推断题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层少4个;E元素原子次外层电子数比最外层多3个。
(1)写出下列元素的符号:A?, E?。
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是?。
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是?。
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为?。
(5)用电子式表示B和F形成化合物的过程________________
参考答案:(1)Na? P?(2)Al(OH)3+OH-=AlO2-+2H2O(3)Al2O3+2NaOH= 2NaAlO2+2H2O
(4) [Ar]3d104s24p5?
(5)2Mg2++
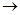 Mg2+
Mg2+ Mg2+
Mg2+
本题解析:A、C、F三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则是酸碱的中和反应,那么C只能是具备两性的Al(OH)3,A为Na;D元素原子的最外层电子数比次外层少4个,所以D为Si;E元素原子次外层电子数比最外层多3个,则E为P,故F只能为Cl。
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。
本题难度:一般