微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图各装置中,不能形成原电池的是(烧杯中所盛液体都是稀硫酸) ( )
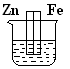
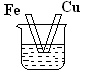
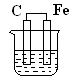

A B C D
参考答案:D
本题解析:构成原电池的条件是活泼性不同的金属或金属与非金属,导线相连且插入电解质溶液中。D中没有形成完整的闭合回路,所以不能构成原电池。答案是D。
本题难度:一般
2、选择题 太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为:? LaNi5+Ni(OH)2 LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
A.放电时镍被还原
B.放电时负极LaNi5H+OH——e—=LaNi5+H2O
C.充电时OH—向阴极移动
D.充电时每消耗lmol Ni(OH)2转移lmol电子
参考答案:C
本题解析:A.根据该太阳能电池放电时的反应原理可知:在放电时LaNi5→LaNi5H,化合价降低,得到电子被还原。正确。B.放电时负极LaNi5H+OH——e—=LaNi5+H2O。正确。C.充电时根据同种电荷相互排斥,异种电荷相互吸引的原则,OH—向阳极移动。错误。D.根据氧化还原反应中化合价升高或降低的总数与电子转移数目相等可得:若充电时每消耗lmol Ni(OH)2转移lmol电子。正确。
本题难度:一般
3、填空题 (15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
氢氧化物
| Cu(OH)2
| Fe(OH)3
| Fe(OH)2
| Mg(OH)2
|
Ksp
| 2.2×10-20
| 4.0×10-38
| 8.0×10-16
| 1.8×10-11
|
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)。
(2)实验室制备氨气的化学方程式为 。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为 。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
温度(K)
| 平衡时NH3的物质的量(mol)
|
T1
| 2.4
|
T2
| 2.0
|
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

参考答案:(1)Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2(2分,顺序不正确不得分)
(2)2NH4Cl+Ca(OH)2  CaCl2+2NH3↑+2H2O(2分,未标加热或气体符号或未配平扣1分)
CaCl2+2NH3↑+2H2O(2分,未标加热或气体符号或未配平扣1分)
2NH3+2OH--2e-=N2H4+2H2O(2分)
(3)①<(2分) ②0.1 mol?L-1?min-1 (2分) 25%(2分)不变(1分) ③BC(2分)
本题解析:(1)溶度积常数越小,越溶液产生沉淀,根据溶度积常数大小可知产生沉淀的先后顺序是Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2。
(2)实验室利用熟石灰与氯化铵加热制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2  CaCl2+2NH3↑+2H2O;原电池中负极失去电子发生氧化反应,因此氨气在负极通入,失去电子转化为肼,所以该电池的负极反应为2NH3+2OH--2e-=N2H4+2H2O。
CaCl2+2NH3↑+2H2O;原电池中负极失去电子发生氧化反应,因此氨气在负极通入,失去电子转化为肼,所以该电池的负极反应为2NH3+2OH--2e-=N2H4+2H2O。
(3)①已知破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量,这说明该反应是放热反应。根据表中数据可知T1时生成的氨气多,温度低有利于氨气的生成,所以T1<T2。
②平衡时氨气的物质的量是2mol,则根据方程式N2+3H2 2NH3可知消耗氢气的物质的量是3mol,浓度是1mol/L,所以0~10min内H2的平均速率v(H2)=1mol/L÷10min=0.1 mol?L-1?min-1 ;消耗氮气的物质的量是1mol,所以氮气的转化率是
2NH3可知消耗氢气的物质的量是3mol,浓度是1mol/L,所以0~10min内H2的平均速率v(H2)=1mol/L÷10min=0.1 mol?L-1?min-1 ;消耗氮气的物质的量是1mol,所以氮气的转化率是 ;平衡常数只与温度有关系,因此若再增加氢气浓度,该反应的平衡常数将不变。
;平衡常数只与温度有关系,因此若再增加氢气浓度,该反应的平衡常数将不变。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A、对于具体的化学方程式反应热是不变,因此反应热不变不能表明该可逆反应达到平衡状态,A错误;B、混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以当平均相对分子质量不再发生变化时,能表明该可逆反应达到平衡状态,B正确;C、当氮气含量不再发生变化时,可以说明反应达到平衡状态,C正确;D、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即密度始终是不变,D错误,答案选BC。
考点:考查溶度积常数应用、氨气制备、电极反应式书写、化学平衡状态的判断、计算等
本题难度:困难
4、填空题 (16分)碳及其化合物应用广泛。
I 工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)  CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0
(1)向1L恒容密闭容器中注入CO(g)和H2O(g),830℃时测得部分数据如下表。则该温度下反应的平衡常数K=______________。
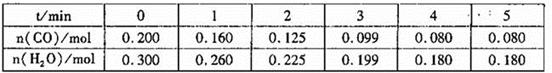
(2)相同条件下,向1L恒容密闭容器中,同时注入2mol CO、2mol H2O(g),1molCO2和1mo1H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
(3)上述反应达到平衡时,要提高CO的转化率,可采取的措施是_______(填字母代号)。
A.升高温度
B.加入催化剂
C.增大压强
D.增加CO的浓度