| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《原电池原理》高频考点强化练习(2017年最新版)(五)
II 已知CO(g)+1/2 O2(g)=CO2(g) △H=一141 kJ·mol-1 2H2(g)+ O2(g)=2H2O(g) △H=一484 kJ·mol-1 CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g) △H=一726 kJ·mol-1 (4)用CO(g)、H2(g)化合制得液态甲醇的热化学方程式为___________________________。 III某同学设计了一个甲醇燃料电池,并用该电池电解100mL一定浓度NaCl与CuSO4混合溶液,其装置如图: 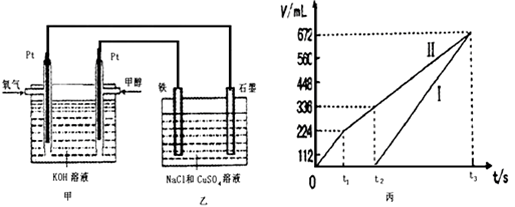 (5)写出甲中通入甲醇这一极的电极反应式__________________________________ 。 (6)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中CuSO4的物质的量浓度____________mol/L。(假设溶液体积不变) (7)将在t2时所得的溶液稀释至200mL,该溶液的pH约为___________。 5、选择题 下列有关说法正确的是( ) |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《有机物燃烧.. | |