微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 合成氨厂所需H2可由焦炭与水反应制得,其中有一步反应为CO(g)+H2O(g)==CO2(g)+H2(g)?△H <0 欲提高CO 转化率,可采用的方法是①降低温度;?②增大压强; ③使用催化剂;④增大CO 浓度;⑤增大水蒸气浓度
[? ? ]
A. ①②③?
B. ④⑤?
C. ①⑤?
D. ⑤
参考答案:C
本题解析:
本题难度:一般
2、选择题 可逆反应:3A(g)?3B(?)+C(?)(△H>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A.B和C可能都是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
参考答案:3A(g)?3B(?)+C(?)(△H>0),该正反应吸热,温度升高,平衡右移,.M变小,依据反应的系数关系,气体平衡体系的质量守恒,平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定;
A、B和C肯定不会都是固体,若都是固体,气体物质的量减小,质量减小,.M不变,故A错误;
B、若都是气体,反应前后气体物质的量一定增大,质量不变,.M减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小,.M减小,故B错误;
C、C为固体,B一定为气体,反应前后气体物质的量不变,气体质量减小,.M减小,故C正确;
D、B和C可能都是气体时,质量守恒,气体物质的量增大,.M减小,故D正确;
故选CD;
本题解析:
本题难度:一般
3、填空题
氢气在化学工业中有广泛用途。
(1)实验室用锌和稀硫酸制取氢气,反应过程中,溶液中水的电离平衡______移动(填“向左”、“向右”或“不”);若加入少量的_________(填编号),产生氢气速率加快。
A.NaNO3 B.CuSO4 C.CH3COONa D.NaHSO3
工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g)。实验室模拟化工生产,控制起始浓度均为
2NH3(g)。实验室模拟化工生产,控制起始浓度均为
c(N2)= 1.50 mol/L、c(H2)=2.50 mol/L,分别在三种不同实验条件下反应,N2浓度随时间变化如下图。

请回答下列问题:
(2)平衡时反应物的转化率:实验Ⅲ比实验I______(填“大”、“小”或“相同”)。
(3)与实验I比较,实验Ⅱ改变的条件为__________, 判断依据是______________________。
(4)实验Ⅲ的平衡常数K=_________;恒温恒容条件下,向实验Ⅲ达到平衡的容器中通入N2和NH3,使N2 和NH3浓度均变为原平衡的2倍,平衡__________(填编号)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断是否移动
参考答案:(1)向右;B
(2)小
(3)加入催化剂;实验Ⅱ和实验I的平衡状态相同,而实验Ⅱ达到平衡所需时间短
(4)1.00;B
本题解析:
本题难度:一般
4、填空题 研究NO2、SO2?、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________。利用反应
6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是__________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是__________L。
(2)已知:
2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6?kJ/mol
2SO3(g)ΔH=-196.6?kJ/mol
2NO(g)+O2(g) 2NO2(g)?ΔH=-113.0?kJ/mol?
2NO2(g)?ΔH=-113.0?kJ/mol?
①写出NO2氧化SO2的热化学方程式______________________
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________。
a.体系压强保持不变?
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变?
d.每消耗1?mol?SO3的同时生成1?molNO2?
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_________。
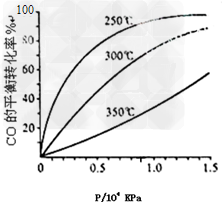
(3)CO可用于合成甲醇,反应方程式为 CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_____0(填“>”或“?<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_____0(填“>”或“?<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______________。
参考答案:(1)3NO2+H2O=NO+2HNO3;6.72
(2)①NO2(g)+SO2(g)=SO3(g)+NO(g)?△H=-41.8kJ/mol;②b;③8/3
(3)<?;?在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失
本题解析:
本题难度:一般
5、填空题 在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间t的变化如下表
2NO2(g)体系中,n(NO)随时间t的变化如下表
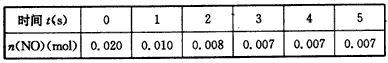
(1)已知平衡常数K300℃>K350℃,则该反应是________热反应。
(2)下图中可用来表示NO2的变化的曲线是________(填字母)。用O2表示从0~2s内该反应的平均速率v=________。
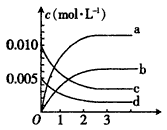
(3)能说明该反应已达到平衡状态的是____。
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d. 容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度 c. 增大O2的浓度 d. 选择高效催化剂
参考答案:(1)放
(2)b;1.5×10-3 mol·L-1·s-1
(3)bc
(4)c
本题解析:
本题难度:一般