微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:
N2O4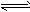 2NO2 △H>0隔一段时间对该容器内的物质进行分析,得到如下数据
2NO2 △H>0隔一段时间对该容器内的物质进行分析,得到如下数据
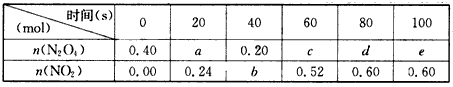
(1)计算20~40s内用N2O4表示的平均反应速率为____mol·L-1·s-1。
(2)计算在80℃时该反应的平衡常数K=____。
(3)要增大该反应的K值,可采取的措施有(填序号)____。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
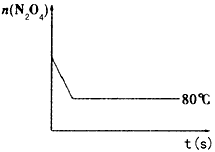
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
2、选择题 关节炎的病因主要是在关节滑液中形成了尿酸钠晶体,主要反应为:Ur-+Na+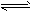 NaUr(s);第一次关节炎发作往往在冬季,有关该反应的说法中,正确的是
NaUr(s);第一次关节炎发作往往在冬季,有关该反应的说法中,正确的是
[? ]
A.正反应是吸热反应
B.正反应是放热反应
C.升高温度平衡向正反应方向移动
D.以上说法都不正确
3、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的△H表示生成
1mol产物的数据)
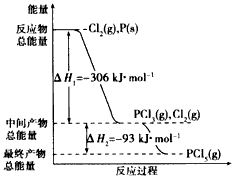
根据上图回答下列问题:
(1)P和Cl2反应生成PC13的热化学方程式是________________________
(2)PCl5分解成PCl3和Cl2的热化学方程式是________________________,上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0. 80 mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率al等于
__________;若反应温度由T1升高到T2,平衡时PCl5的分解率为a2,a2_________a1(填“大于”、“小 于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是______________________________
(4)P和Cl2分两步反应生成l mol PCl5的△H3=_____________,P和Cl2一步反应生成1 mol PCl5的△H4
_______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_______________________。
4、选择题 有平衡体系CO(g)+2H2(g)═CH3OH(g)△H<0,为增加甲醇的产量,应采取的正确措施是( )
A.高温、高压
B.适宜的温度、高压、催化剂
C.低温、高压、催化剂
D.高温、高压、催化剂
5、选择题 某温度下,反应H2(g)+I2(g)?2HI(g);△H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是( )
A.温度不变,压缩气体的体积,平衡不移动,混合气体颜色加深
B.温度、压强均不变,充人HI气体,开始时正反应速率增大
C.体积不变,升温正反应速率减小
D.体积、温度不变,充入氦气后,正反应速率将增大