微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)下表为周期表的一部分,其中的编号代表对应的元素。
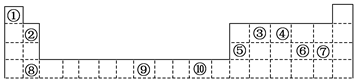
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为?对。
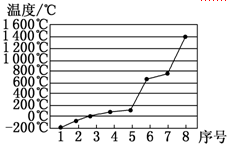
(4)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填元素符号)。
参考答案:(1)⑨? (2)1S22S22P63S23P63d64S2?(3)? 1? (4)? Si? Cl
本题解析:属于d区的元素是⑨,⑨是Fe基态原子的电子排布式为1S22S22P63S23P63d64S2。根据电子排布式nsnnpn+1可知n=2,所以最外层电子的成对电子有1对,“8”代表的元素沸点最高,第三周期中沸点最高的是Si,电负性最大的是Cl。
点评:本题非常基础简单,主要考查学生对元素周期律的掌握。
本题难度:一般
2、填空题 (7分)按要求填空:
(1)某阴离子核外18电子,带两个单位负电荷,其离子结构示意图?。
(2)含6个质子、8个中子的原子符号为???,它与16O形成3原子分子甲,4.6克甲的物质的量是???mol,甲分子中相邻原子间以??键结合(填“离子键”或“共价键”)。
(3)铁原子核外有4个电子层,在周期表第8列,它在元素周期表的第?周期?族。
(4)盛放碱液的试剂瓶不能用玻璃塞,是为了防止发生?
反应(以NaOH为例用化学方程式表示),避免瓶塞与瓶口粘在一起
参考答案:(1) S2-?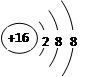 ?(2)(1+1+1分)?146C,? 0.1,共价键?
?(2)(1+1+1分)?146C,? 0.1,共价键?
(3)(1分)四,第Ⅷ
(4)(2分)SiO2 + 2NaOH? =?Na2 CO3+ H2O
本题解析:(1)离子结构示意图为

(2)含6个质子、8个中子的原子符号为146C,甲的物质的量0.1mol,甲分子中相邻原子间以共价键结合
(3)铁在元素周期表的第四周期第Ⅷ族
(4)为了防止发生SiO2 + 2NaOH = Na2 CO3+ H2O
本题难度:一般
3、选择题 aA、bB、cC、dD、eE五种短周期元素,它们的原子序数有如下关系:c-b=b-a=1且 b+c=d,常见化合物E2C2与水反应生成C的单质,且溶液使酚酞试液变红。B的最高价氧化物对应水化物为强酸。下列说法正确的是
A、B与D形成的单质分别为甲、乙,非金属性:B>D,活泼性:乙>甲
B、1molE2C2与足量水完全反应生成C的单质,共转移电子2mol
C、原子半径:D>E>A>B>C
D、C的氢化物的沸点低于B的氢化物的沸点
参考答案:A
本题解析:常见化合物E2C2与水反应生成C的单质,且溶液使酚酞试液变红,说明E是Na,C是O。所以B是N,A是C,则D是P。所以A正确。B不正确,应该是1mol电子。C不正确,原子半径是E>D>A>B>C。常温下水是液态,氨气是气态,所以沸点是水的高于氨气的,D不正确。答案选A。
本题难度:一般
4、填空题 (13分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z 在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)L的元素符号为?;M在元素周期表中的位置为?。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是?。
(3)Y的最高价氧化物的电子式为?。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是?。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为?。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一 种新型无机非金属材料,其化学式是?。
种新型无机非金属材料,其化学式是?。
参考答案:(13分)(1)Si(1分)?第三周期第ⅦA族(2分)
(2)H2SiO3 < H2CO3 < HClO4(2分)
(3)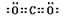 (2分)? 2H2O2
(2分)? 2H2O2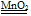 ?2H2O + O2↑(或其他合理答案)(2分)
?2H2O + O2↑(或其他合理答案)(2分)
(4)Al(OH)3 + OH-=== AlO2-+ 2H2O?(2分)?(5)Si3N4?(2分)
本题解析:略
本题难度:简单
5、填空题 (8分)A、B、C均为短周期元素,它们在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)A、B、C三种元素的名称分别为_________、__________、________;
(2)B元素位于元素周期表中第______周期第____族;
(3)C元素的原子结构示意图为____________,
(4)A、B、C三种元素的原子半径从大到小排列顺序为________(用元素符号表示)
参考答案:(共8分)(1)氮、硫、氟(各1分)(2)3、ⅥA (各1分)
(3)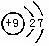 (1分)?(4)S>N>F(2分)
(1分)?(4)S>N>F(2分)
本题解析:设A的原子序数为x,则根据元素在周期表中的位置可知,BC的原子序数为x+、x+2,所以有x+x+2=x+9,解得x=7,即A是N,B是S,C是F。
(1)分别是氮、硫、氟
(2)B的原子序数是16,位于第三周期第ⅥA。
(3)C的核外电子数是9个,其原子结构示意图为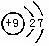 。
。
(4)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径从大到小排列顺序为S>N>F。
本题难度:简单