微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实中能证明甲烷分子是以碳原子为中心的正四面体结构的是
A.甲烷有四个相等碳氢键
B.甲烷的三氯代物只有一种
C.甲烷的一氯代物只有一种
D.甲烷的二氯代物只有一种
参考答案:D
本题解析:
本题难度:简单
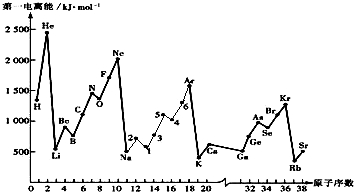
2、填空题 如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.请回答以下问题:

(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图象.
(2)从如图分析可知,同一主族元素原子的第一电离能I1变化规律是______;
(3)图中5号元素在周期表中的位置是______、______;
(4)如图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:______.
参考答案:(1)根据图片知,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以其图象为
;
故答案为:

;
(2)根据图片知,同一主族元素的第一电离能随着原子序数的增大而减小,
故答案为:同一主族元素的第一电离能随着原子序数的增大而减小;
(3)该元素是P元素,其原子结构示意图为
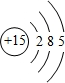
,P原子含有3的电子层,最外层有5个电子,所以该元素属于第三周期、第VA族,故答案为:第三周期;第VA族;
(4)P、S、Cl三种元素的氢化物中只存在分子间作用力,不含氢键,N、O、F三种元素的氢化物中含有氢键,氢键的存在导致其氢化物沸点升高,
故答案为:4、5、6三种元素的同主族上一周期的元素气态氢化物中含有氢键,氢键的存在导致物质的沸点增大.
本题解析:
本题难度:一般
3、简答题 不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.
下面是某些短周期元素的x值;
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl
x值
0.98
1.57
2.04
2.55
3.44
3.98
0.93
1.61
1.90
2.19
2.58
3.16
|
(1)通过分析x值变化规律,确定N、Mg的x值范围;
______<x(Mg)<______,______<x(N)<______.
(2)推测x值与原子半径的关系是______;根据短周期元素x值变化特点,体现了元素性质的______变化规律.
(3)某有机化合物结构式为C6H5-S-NH2,其中S-N中,你认为共用电子对偏向谁?
______(写原子名称).
(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是______.
(5)预测元素周期表中,x值最小的元素位置:______(放射性元素除外).
参考答案:(1)同一周期从左到右,元素的电负性逐渐增大,则N元素的电负性介于C元素和O元素之间,即介于2.55~3.44之间,则Mg的电负性大于Na的电负性,即大于0.93,同一主族从上到下元素的电负性逐渐减小,则Mg的电负性小于Be的电负性,即小于1.57,
故答案为:0.93<x(Mg)<1.57,2,55<x(N)<3.44;
(2)同一周期周期从左到右,元素的电负性逐渐增大,半径逐渐减小,同一主族从上到下,元素的电负性逐渐减小,原子半径逐渐增大,所以同周期(同主族)中,x值越大,其原子半径越小,体现了元素性质的周期性变化的规律.
故答案为:同周期(同主族)中,x值越大,其原子半径越小;周期性;
(3)N元素的电负性大于S元素,吸电子能力较强,则在S-N中,电子对偏向于N元素,故答案为:氮原子;
(4)AlBr3中,Al元素的电负性为1.61,Br元素的电负性小于3.16,则二者差值小于1.7,AlBr3中化学键类型为共价键,
故答案为:共价键;
(5)根据同一周期周期从左到右,元素的电负性逐渐增大,同一主族从上到下,元素的电负性逐渐减小,则电负性最小的元素应位于周期表的左下角,排除放射性元素,应为Cs元素,位于第六周期IA族,
故答案为:第六周期IA族
本题解析:
本题难度:一般
4、填空题 在下列空格中,填上适当的元素符号。
(1)在第三周期中,第一电离能最小的元素是_____,第一电离能最大的元素是_____。
(2)在元素周期表中,电负性最大的元素是_____,电负性最小的元素是____。
参考答案:(1)Na;Ar
(2)F;Fr
本题解析:
本题难度:一般
5、选择题 气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……下表是第三周期部分元素的电离能[单位: eV(电子伏特)]数据。
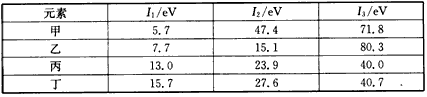
下列说法正确的是
[? ]
A.甲的金属性比乙强
B.乙的化合价为+1价
C.丙一定为非金属元素
D.丁一定是金属元素
参考答案:A
本题解析:
本题难度:一般