微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列获取物质的方法中,正确的是
A.蒸干FeCl3溶液得到FeCl3固体
B.实验室用Nal与浓H2SO4反应制HI
C.用碳酸钠和氢氧化钙反应制氢氧化钠
D.工业上用水吸收SO3得到硫酸
|
2、简答题 溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
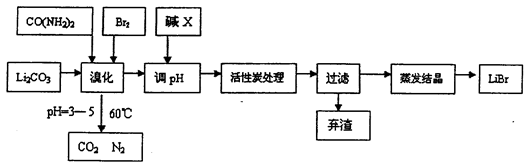
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
3、实验题 下列装置为中学化学实验常用的气体制备装置
 ?
? ?
?
A? B? C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 ?。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 ?。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置?。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置?。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 ?。
写出氯气和氯化亚铁溶液反应的离子方程式:?。
③请写出氯气尾气处理的离子方程式 ??。
4、填空题 (10分)农村还有些家庭直接用河水或池塘水或井水龙头作为生活饮用水,一般是把水担回家倒入水缸,加明矾使水澄清,加漂白粉进行消毒,煮沸消除暂时硬度,明矾的化学式为?,写出它溶于水后生成胶体的离子方程式:?。漂白粉的成分是?,它在自然条件下能产生次氯酸,次氯酸的氧化性很强,能杀死病菌。写出漂白粉在空气中生成次氯酸的化学方程式:?。煮沸时形成水垢的成份是?(填化学式)
5、填空题 实验室常用浓硫酸和乙醇混合加
 热制取乙烯。
热制取乙烯。
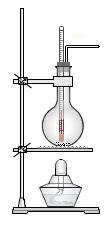
(1) 实验室制乙烯的化学方程式为?。
(2)实验室用浓硫酸和乙醇混合加热制乙烯可用如上图所示装置,下列说法正确的是?。
A.浓硫酸只作催化剂?
B.在反应容器中放入几片碎瓷片防止混合液暴沸
C.反应温度缓慢上升至170℃?
D.用排水法或向下排气法收集乙烯
E.园底烧瓶中装得是4mL乙醇和12mL3mol/L H2SO4混合液
F.温度计应 插入反应溶液液面下,以便控制温度
插入反应溶液液面下,以便控制温度
G.反应完毕后先熄灭酒精灯,再从水中取出导管
(3)若将此装置中的温度计换成分液漏斗,则还可以制取的气体有(酒精灯 可用可不用)?。
可用可不用)?。
A.CO2?B.NH3?C.O2? D.SO2?E.NO2?F.Cl2
(4) 如温度过高,反应后溶液颜色变?。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。

①I、II、III、IV装置可盛放的试剂是(请将下列有关试剂的序号填入空格内):
A、品红 ?B、NaOH溶液 ?C、浓硫酸?D、酸性KMnO4溶液
I? ?;II?;III?;IV?。
?;II?;III?;IV?。
②能说明SO2气体存在的现象是 ?
③使用装置II的目的是?;
④使用置III的目的是 ?;
⑤确定含有乙烯的现象是?。