微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验原理或实验操作正确的是
A.用水湿润pH试纸测量某溶液的pH
B.用量筒量取20mol ?L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol?L-1H2SO4溶液
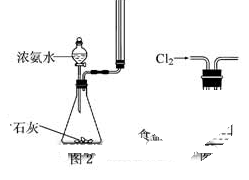
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置出去Cl2中的少量HCl
参考答案:D
本题解析:
答案:D
【分析】本题属于基础实验与基本实验操作的考查范畴。
A.pH试纸用水湿润将冲稀待测溶液。
B.0.5000 mol·L-1 H2SO4溶液与水混合,混合溶液的体积不是两者的简单之和。
C.收集试管带塞子将无法收集到氨气。
D.根据溶解平衡原理,Cl2在饱和食盐水溶解度很小,而HCl极易溶解。
本题难度:一般
2、填空题 (6分)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+四种离子,甲、乙、丙三位同学设计从污水中回收铜的方案如下:

(1)以上实验方案能否得到铜(填“能”或“不能”):甲_______,乙________。
(2)在可制得铜的方案中,写出所有反应的离子方程式_______________________。
参考答案:(6分)(1)不能 ?能?(各1分,共2分)
(2)Fe+2Fe3+=3Fe2+? Fe+Cu2+=Fe2++Cu?Fe+2H+=Fe2++H2↑?(一个2分,对2个给4分,共4分)
本题解析:略
本题难度:一般
3、选择题 右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是
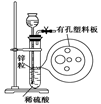
①食盐水?②KNO3溶液?③适量稀硫酸铜溶液
④Na2CO3溶液?⑤CCl4?⑥浓氨水
A.①③⑤
B.①②③
C.④⑤⑥
D.①②③⑤
参考答案:A
本题解析:略
本题难度:一般
4、填空题 (12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产

根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为?。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替??
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是?。
A.适当加热? B.加压? C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是?。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是?。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为?。
参考答案:每空均2分
(1)100%
(2)否,因为乙醇与过氧化氢溶液及烷基蒽醌 等都互溶,无法萃取,难于与工作液分离(判断正确即可得2分)
等都互溶,无法萃取,难于与工作液分离(判断正确即可得2分)
(3)AB(错选不得分,漏选得1分)
(4)回收RAQ(及HRAQ)及有机溶剂并循环使用。
(5)减压蒸馏(填:蒸馏得1分)
(6)Cu+2H++H2O2=Cu2++2H2O
本题解析:略
本题难度:简单
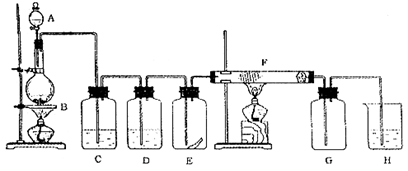
5、实验题 (14分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
试回答:
(1)A中所放试剂为?,B中所放试剂为?,二者反应的化学方程式为?,
(2)为得到干燥纯净的氯气,一般在C瓶中加入?试剂,D瓶中加入?试剂。
(3)E瓶中现象为?; F中反应的化学方程式为?。
(4)H中应加入的试剂为?,其作用是?。
其化学方程式为?。
参考答案:(14分)
(1) 浓盐酸? (1分)???MnO2? (1分)???MnO2+4HCl(浓)="===" MnCl2+Cl2+2H2O (2分)?
(2)?饱和NaCl溶液(1分)???浓硫酸? (1分)?
(3)?红色褪去? (1分)???Cu+Cl2?====? CuCl2? (2分)
(4)? NaOH溶液(1分)???吸收多余氯气,防止污染空气? (2分)?
Cl2+2NaOH?====? NaCl+NaClO+H2O? (2分)
本题解析:(1)该实验装置为舍勒制氯气,A中所放试剂为浓盐酸,B中所放试剂为MnO2;其反应的化学方程式为:MnO2+4HCl(浓)="===" MnCl2+Cl2+2H2O;
(2)为得到干燥纯净的氯气,一般在C瓶中加入饱和NaCl溶液,D瓶中加入浓硫酸;
(3)E瓶中现象为红色褪去;F中反应的化学方程式为Cu+Cl2?====? CuCl2;
(4)H中应加入的试剂为NaOH溶液;其作用是吸收多余氯气,防止污染空气;反应的方程式为:Cl2+2NaOH? ====? NaCl+NaClO+H2O
本题难度:一般