微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 填空题(共7分)
(1)SO2到品红溶液,溶液褪色,SO2体现______性。
(2)SO2到酸性高锰酸钾溶液,溶液褪色,SO2体现_____性
(3)SO2到紫色石蕊溶液,溶液变____, SO2体现______性
(4)过量的氯气通到紫色石蕊溶液,溶液先变_____,后_____,?最终溶液为
__________色。
参考答案:(各1分,共7分)漂白,还原,红,酸,红,褪色,淡黄绿色
本题解析:SO2具有漂白性,能使品红溶液褪色;SO2具有还原性,能被酸性高锰酸钾溶液氧化褪色;SO2是酸性氧化物,溶于水生成亚硫酸,溶液显酸性,使紫色的石蕊试液变红色;氯气溶于水生成氯化氢和次氯酸,所以过量的氯气通到紫色石蕊溶液,溶液先变红色,后褪色,最终溶液为淡黄绿色。2的性质
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础性知识的巩固和训练,有利于培养学生灵活运用基础知识解决实际问题的能力,提高学生的应试能力和学习效率。
本题难度:一般
2、选择题 FeSO4和Fe2(SO4)3的混合物中含硫的质量分数为a%,则含铁的质量分数为
A.2a%
B.3a%
C.1-2a%
D.1-3a%
参考答案:D
本题解析:S%="a%?" O%="2a%?" Fe%=1-a%-2a%=1-3a%
本题难度:一般
3、实验题 某化学课外兴趣小组探究铜与浓硫酸的反应情况及某些产物的性质。
(Ⅰ)甲、乙两同学进行了下列实验:取一定量的铜片和20 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识认为还有较多硫酸剩余。
(1)铜与浓硫酸反应的化学方程式是:?
可以证明有余酸的实验方案是_?(填字母)。
a.再加入适量NaNO3固体B.再滴入BaCl2溶液 C.再加入银 D.再滴入Na2CO3溶液
(2)甲同学设计求余酸浓度的实验方案是测定产生气体的量。下列方案中不可行的是?(填字母)。
a.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,反应结束后再次称量
b.将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
c.用排水法测定其产生气体的体积(折算成标准状况)
d.用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀的质量为W g,测得反应后溶液的体积为V mL。则剩余硫酸的物质的量浓度为?mol/L(用含W、V的代数式表示)。
(Ⅱ)丙同学探究SO2与BaCl2溶液能否反应生成白色BaSO3沉淀。
丙同学先将产生的气体通过盛有饱和NaHSO3溶液的洗气瓶,再缓缓通入BaCl2溶液中,观察到有少量白色沉淀生成,检验白色沉淀,发现沉淀全部不溶于稀盐酸,该沉淀的生成表明SO2具有?性。用一个离子方程式解释生成此沉淀的原因?。
参考答案:(Ⅰ) (1) Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O(2分)? ad?(2) abc(2分)(3)
CuSO4+SO2↑+2H2O(2分)? ad?(2) abc(2分)(3) 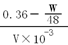 ?
?
(Ⅱ) 还原(2分)? 2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+(2分)
本题解析:(Ⅰ)(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式为:
Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O;因反应后有硫酸铜生成,证明有余酸应检验混合液中含有氢离子,a.若有余酸,再加入适量NaNO3固体可发生反应:3Cu + 2NO3- + 8H+ =?3Cu2+ + 2NO↑+ 4H2O,剩余的铜溶解,有气体生成,在试管口变红棕色,可以证明; b.滴入BaCl2溶液,与氢离子不反应,不能证明; C.再加入银 ,与氢离子不反应,不能证明;D.再滴入Na2CO3溶液,与氢离子反应有无色气体生成,可以证明;选ad;(2)甲同学设计求余酸浓度的实验方案是测定产生气体的量。a.产生的气体中含有水蒸气也能被碱石灰吸收,会产生误差,不可行;b.酸性高锰酸钾溶液是用硫酸酸化的,产生的气体通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀,沉淀的量偏大,不可行;c.二氧化硫易溶于水,用排水法测定其产生气体的体积,不可行;d.二氧化硫不溶于饱和NaHSO3溶液,用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况),可行;选abc;(3)乙同学设计测定余酸浓度的实验方案涉及反应为:
CuSO4+SO2↑+2H2O;因反应后有硫酸铜生成,证明有余酸应检验混合液中含有氢离子,a.若有余酸,再加入适量NaNO3固体可发生反应:3Cu + 2NO3- + 8H+ =?3Cu2+ + 2NO↑+ 4H2O,剩余的铜溶解,有气体生成,在试管口变红棕色,可以证明; b.滴入BaCl2溶液,与氢离子不反应,不能证明; C.再加入银 ,与氢离子不反应,不能证明;D.再滴入Na2CO3溶液,与氢离子反应有无色气体生成,可以证明;选ad;(2)甲同学设计求余酸浓度的实验方案是测定产生气体的量。a.产生的气体中含有水蒸气也能被碱石灰吸收,会产生误差,不可行;b.酸性高锰酸钾溶液是用硫酸酸化的,产生的气体通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀,沉淀的量偏大,不可行;c.二氧化硫易溶于水,用排水法测定其产生气体的体积,不可行;d.二氧化硫不溶于饱和NaHSO3溶液,用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况),可行;选abc;(3)乙同学设计测定余酸浓度的实验方案涉及反应为:
Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O,Cu2+ + S2-=? CuS↓,根据化学方程式的硫化铜与参加反应的硫酸的关系式:CuS——2H2SO4,则参加反应的硫酸的物质的量为W /48mol,剩余硫酸的物质的量为(0.36—W /48)mol,物质的量浓度为
CuSO4+SO2↑+2H2O,Cu2+ + S2-=? CuS↓,根据化学方程式的硫化铜与参加反应的硫酸的关系式:CuS——2H2SO4,则参加反应的硫酸的物质的量为W /48mol,剩余硫酸的物质的量为(0.36—W /48)mol,物质的量浓度为 mol/L。
mol/L。
(Ⅱ) 丙同学先将产生的气体通过盛有饱和NaHSO3溶液的洗气瓶,再缓缓通入BaCl2溶液中,观察到有少量白色沉淀生成,检验白色沉淀,发现沉淀全部不溶于稀盐酸,则该沉淀为硫酸钡,产生该沉淀的原因为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+,SO2表现还原性。
本题难度:困难
4、选择题 要制得较纯净的FeS沉淀,在FeCl2溶液中最好加入的试剂是……( )
A.(NH4)2S
B.Na2S
C.H2S
D.NaHS
参考答案:A
本题解析:选项C、D根本不能生成FeS沉淀,排除。
选项A、B均能产生FeS沉淀,只是因为
S2-+2H2O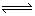 2OH-+H2S(有强碱生成)
2OH-+H2S(有强碱生成)
(NH4)2S+2H2O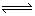 2NH3·H2O+H2S
2NH3·H2O+H2S
由此因为氨水是弱碱,所以可知硫化钠水解后碱性大这样就会产生Fe(OH)2沉淀而使生成的FeS不纯。因此,最好的试剂还是选项A。
本题难度:一般
5、选择题 下列实验过程中产生的现象与对应的图形相符的是
A? NaHSO3粉末加入HNO3溶液中 B? H2S气体通入氯水中
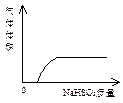 ?
?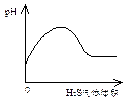
C? NaOH溶液滴入Ba(HCO3)2 D? CO2气体通入澄清石灰水中
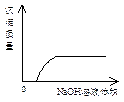 ?
?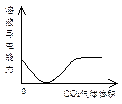
参考答案:D
本题解析:亚硫酸钠加入硝酸溶液中,硝酸跟亚硫酸氢钠间可能发生氧化还原反应(生成氮的氧化物和硫酸盐),所以一开始就会有气体产物,题给图像中的曲线不能正确反映实际情况。
硫化氢通入氯水中,很容易发生下列反应:H2S+Cl2=2HCl+S。所以,反应一开始溶液的pH会降低。图像错误。
氢氧化钠滴入碳酸氢钡溶液中,一开始就会有沉淀生成。图像也不正确。
CO2通入澄清石灰水中,反应分两个阶段。先是:CO2+Ca2++2OH-=CaCO3↓+H2O;再是:CaCO3+CO2+H2O=Ca2++2HCO3-。对应的溶液的导电性先减弱,再增强。图像基本正确。
本题难度:简单