微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 将6.4 g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余。试计算:(要求有计算过程)
(1)生成的SO2的体积(标准状况下)。
(2)若用4 mol·L-1的NaOH溶液吸收生成的SO2 ,恰好生成Na2SO3 ,计算需要NaOH溶液的体积。
参考答案:(1)2.24 L?(2分)
(2)0.05 L或50 mL?(2分)
本题解析:(1)6.4gCu的物质的量为0.1mol,根据Cu+2H2SO4(浓)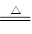 CuSO4+SO2↑+2H2O可知,n(SO2)=n(Cu)=0.1mol,故生成SO2的体积为0.1mol×22.4L/mol=2.24L,答:生成SO2的体积为2.24L;
CuSO4+SO2↑+2H2O可知,n(SO2)=n(Cu)=0.1mol,故生成SO2的体积为0.1mol×22.4L/mol=2.24L,答:生成SO2的体积为2.24L;
(2)根据硫元素守恒可知n(Na2SO3)=n(SO2)=0.1mol,根据钠离子守恒可知
n(NaOH)=2n(Na2SO3)=0.2mol,故需要NaOH溶液的体积为0.05L,
答:需要NaOH溶液的体积为0.05L.
本题难度:一般
2、选择题 0.5L 1mol/L FeCl3溶液与0.2L 1mol/LKCl溶液中的C(Cl-)之比是
A.5 :2
B.15 :2
C.3 :1
D.1 :3
参考答案:C
本题解析:略
本题难度:一般
3、选择题 设阿伏加德罗常数为NA,下列说法正确的是(?)
A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA
B.1 mol NH3含有的电子数10NA
C.常温常压下,22.4L的氧气含氧原子数为2NA
D.常温下,1L0.1mol/L AlCl3溶液中含Al3+数为0.1NA
参考答案:B
本题解析:由m/M可知,n(Fe)=0.1mol,由2Fe+3Cl2 2FeCl3~6e—可知,n(e—)失去=3n(Fe)=0.3mol,故A项错误;由1个NH3含有10个电子可知,1molNH3含有10mol电子,故B项正确;常温常压下Vm>22.4L/mol,由V/Vm可知,n(O2)<1mol,由O2~2O可知,n(O)<2mol,故C项错误;由c?V可知,n(AlCl3)=0.1mol,由电解质的电离、盐类水解可知,n(Al3+)<0.1mol,故D项错误。
2FeCl3~6e—可知,n(e—)失去=3n(Fe)=0.3mol,故A项错误;由1个NH3含有10个电子可知,1molNH3含有10mol电子,故B项正确;常温常压下Vm>22.4L/mol,由V/Vm可知,n(O2)<1mol,由O2~2O可知,n(O)<2mol,故C项错误;由c?V可知,n(AlCl3)=0.1mol,由电解质的电离、盐类水解可知,n(Al3+)<0.1mol,故D项错误。
本题难度:简单
4、选择题 设阿伏加德罗常数的数值为NA,下列说法正确的是(?)
A.足量Fe与1 mol Cl2燃烧反应时,转移的电子数为3 NA
B.1 mol NO2与足量H2O反应,转移的电子数为NA
C.常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为0.2 NA
D.高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数为0.4 NA
参考答案:C
本题解析:氯气做氧化剂,得到2个电子,则足量Fe与1 mol Cl2燃烧反应时,转移的电子数为2NA,A不正确;NO2和水反应的方程式是3NO2+H2O=2HNO3+NO,反应中转移2个电子,则1 mol NO2与足量H2O反应,转移的电子数为2/3NA,B不正确;NO2和N2O4的最简式都是NO2,所以常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为 ,即为0.2 NA,C正确;SO2和氧气反应生成三氧化硫的反应是可逆反应,则高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数小于0.4 NA,D不正确,答案选C。
,即为0.2 NA,C正确;SO2和氧气反应生成三氧化硫的反应是可逆反应,则高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数小于0.4 NA,D不正确,答案选C。
本题难度:一般
5、选择题 一定量的14%氢氧化钾溶液,若将其蒸发掉100 g水后,其质量分数为28%,体积为125 mL,则浓缩后的KOH的物质的量浓度为(? )
A.2.2 mol·L-1
B.4 mol·L-1
C.5 mol·L-1
D.6.25 mol·L-1
参考答案:B
本题解析:设原溶液质量为x,根据浓缩前后溶质质量不变,有x×14%="(x-100" g)×28%? x="200" g
c(KOH)=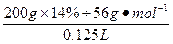 ="4" mol·L-1
="4" mol·L-1
本题难度:简单