微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了下图所示的装置进行实验制取SO2的反应。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题:
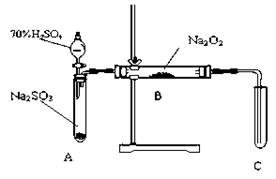
(3)? 请你完成装置改进的措施和理由:
请你完成装置改进的措施和理由:
 ①措施:在A、B之间加一个干燥管,
①措施:在A、B之间加一个干燥管, 作用_______________________________________。
作用_______________________________________。
 ②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶,
②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶, 作用_______________________。
作用_______________________。
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是____________________________。
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
①?提出合理假设:
假设1:白色固体为Na2SO3;?假设2: ? ;
假设3:白色固体为Na2SO3与Na2SO4的混合物。
②?设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
实验操作
| 预期现象与结论
|
步骤1:取少量白色固体于试管,加入?,塞上单孔胶塞,将生成的气体通入?。
| 若?,说明白色固体含有Na2SO3,则?成立,若无该现象,
则?成立。
|
步骤2:在步骤1反应后的溶液加入?。
| 若?,则说明白色固体含Na2SO4。
结合步骤1的结论,则?成立,若无该现象,则?则?成立。
2、填空题 (11分)I.“阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合。综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:
A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);
B.溶解热效应实验(如硝酸铵溶于水);
C.装置的气密性检验实验;
D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等。
|
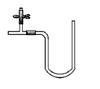 ?
?
请从A或B中选择一项实验,画出该实验的装置图,写出实验名称。要求:①除U形气压计外,其他实验仪器或用品仅能从以下仪器中选取: 广口瓶、小试管、胶头滴管、橡皮塞、乳胶管、导管;②实验药品或试剂自定,但需在图中注明。
广口瓶、小试管、胶头滴管、橡皮塞、乳胶管、导管;②实验药品或试剂自定,但需在图中注明。

实验名称:?
Ⅱ .广口瓶简单,但它的用途真不简单!实验室用Zn粒和盐酸反应制得的H2,其中含酸雾、水汽、硫化氢及少量氧气等杂质气体,某同学仅用四只广口瓶设计了以下几种装置,按一定顺序连接,便达到了当气体通过时,每一装置除去一种气体的目的。
.广口瓶简单,但它的用途真不简单!实验室用Zn粒和盐酸反应制得的H2,其中含酸雾、水汽、硫化氢及少量氧气等杂质气体,某同学仅用四只广口瓶设计了以下几种装置,按一定顺序连接,便达到了当气体通过时,每一装置除去一种气体的目的。
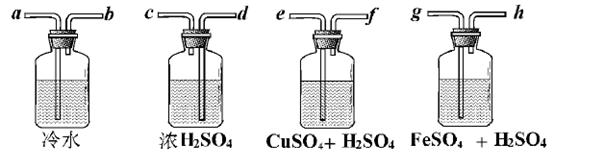
(1)它们连接的顺序为________________________________;
(2)除去H2S的离子方程式为________________;
(3)除去O 2的离子方程式为________________,观察到的现象为________________。
2的离子方程式为________________,观察到的现象为________________。
3、实验题 “阳光”牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答下列有关问题。
(1)取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”的铁已部分被_____________。
(2)将(1)中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是______________________;将滤渣分为两等份,每一份质量为8.0g将其中一份在氧气流中充分灼烧,生成的气体全部通入足量澄清石灰水,得到干燥、纯净的沉淀20.0g。8.0g滤渣中活性炭的质量为____________________。将另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。滤出不溶物。向滤液中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
(3)结论:该“脱氧荆”中的Fe粉和活性炭质量之比约为_____________________。
4、实验题 (18分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取1.500 g样品,加水溶解,配成250 mL溶液。
步骤Ⅱ用酸式滴定管量取25.00 mL样品溶液于 250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。?
250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。?
⑴根据实验步骤填空:
①步骤Ⅰ中用到的主要玻璃仪器有?;
②步骤Ⅱ中酸式滴定管用蒸馏水洗涤后,直接加入样品溶液进行量取,则测得样品中氮质量分数?(填“偏高”、“偏低”或“无影响”,下同)。锥形瓶用蒸馏水洗涤后,水未倒尽,则对滴定时用去NaOH标准溶液的体积?。滴定时对NaOH标准溶液体积,读取初读数时仰视,读取终读数时姿势正确,则测得样品中氮质量分数?。
③滴定时边滴边摇动锥形瓶,眼睛应观察?
A.滴定管内液面的变化?
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由?色变成?色。
⑵滴定结果如表所示:
滴定次数
| 待测溶液体积/ml
| 标准NaOH溶液体积读数(ml)
|
滴定前/ml
| 滴定后/ml
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 2.30
| 22.30
|
则消耗NaOH标准溶液的体积平均为?,该样品中氮的质量分数为?。
5、填空题 某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验方案
| 实验现象
|
①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置
| A.浮在水面上,熔成小球,不定向移动,随之消失
|
②将一小块金属钠放入冷水中
| B.分层,上层无色,下层紫色
|
③将溴水滴加到NaI溶液中,振荡后,再加入适量CCl4,再振荡,静置
| C.浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失
|
④将一小块金属钾放入冷水中
| D.分层,上层无色,下层橙色
|
请你帮助该同学整理并完成实验报告。
(1)实验目的:_______________________________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1 mol·L-1 NaBr溶液、0.1 mol·L-1 NaI溶液、CCl4等。
②仪器:________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
实验方案
| 实验现象
| 化学方程式
|
①
| ?
| ?
|
②
| ?
| ?
|
③
| ?
| ?
|
④
| ?
| ?
|
(4)实验结论:________________________________________________________________________。
(5)请用原子结构的知识简单解释上述实验结论________________________________________________。