微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) 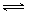 ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 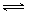 ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
第二步:H2NCOONH4(l) 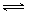 ?H2O(l)+H2NCONH2(l)?△H2
?H2O(l)+H2NCONH2(l)?△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
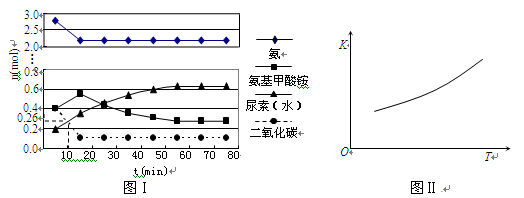
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
参考答案:15分)⑴B?
⑵①2? 55?②0.148 mol/(L·min)? ③>
(每空3分,共15分)
本题解析:(1)由方程式2NH3(l)+CO2(g) 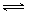 ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
(2)①合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 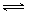 ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
第二步:H2NCOONH4(l) 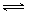 ?H2O(l)+H2NCONH2(l)?△H2;
?H2O(l)+H2NCONH2(l)?△H2;
从图形分析,第一步反应达平衡时时间更短,第二步反应达平衡时间更长,所以,合成尿素总反应的快慢由第二步决定;总反应进行到55min时到达平衡。
②v(CO2)=0.148 mol/(L·min);
③由图II可得,△H2>0;
本题难度:一般
2、选择题 与普通玻璃具有相同组成的是
A.光学玻璃
B.有色玻璃
C.钢化玻璃
D.有机玻璃
参考答案:C
本题解析:钢化玻璃是由普通玻璃经过急剧降温得到的.其成分与普通玻璃完全相同.
本题难度:简单
3、选择题 有资料显示,铝元素在人体内的积累量过多时会对大脑的发育产生不良影响,建议多使用不锈钢代替铝合金作为材料制作餐具、厨具等日用品。下列说法中不正确的是
[? ]
A.不锈钢中含有元素镍、铬
B.不锈钢属于铁合金
C.不锈钢具有一定程度的防腐蚀性
D.不锈钢是绝对不能被腐蚀的
参考答案:D
本题解析:
本题难度:简单
4、填空题 (12分)工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
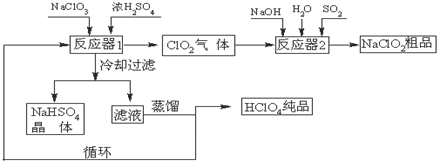
(1)冷却过滤的目的是降低NaHSO4的?并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为??。SO2的作用是作?剂。
(3)循环使用的物质是?。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是?。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)?。
参考答案:(12分)(1)溶解度(2分)(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;(2分)还原(2分)
(3)H2SO4(2分)?(4)高氯酸的沸点比较低,容易从溶液中逸出;(2分)
(5)阳极反应式? HCl+ 4H2O -8e—= HClO4?+ 8H+。(2分)
本题解析:(1)溶解度?NaHSO4的溶解度随温度的升高而增大,随温度的降低而减小。冷却后更易析出NaHSO4晶体。
(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O
在反应中由的SO2硫元素由+4价到+6价,失去电子,为还原剂
(4)蒸馏时,物质按沸点由低到高依次被蒸馏出。高氯酸的沸点为90 oC,很容易蒸出
(5)根据电解池原理,阳极物质失去电子,化合价升高,被氧化
本题难度:一般
5、选择题 合金具有许多优良的性能.下列物质属于合金的是( )
A.钠
B.硫
C.青铜
D.氧化铜
参考答案:C
本题解析:
本题难度:简单