微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对题9图实验装置的说法正确的是

A.利用①可以制取乙烯
B.装置②可配制一定物质的量浓度的稀硫酸
C.利用③可以进行中和热测定
D.利用④可以进行草酸晶体的分解实验
参考答案:D
本题解析:实验室制取乙烯,需要控制溶液的温度为170℃,因此温度计的水银球应该插入到溶液中,A不正确。浓硫酸不能在量筒中稀释,B不正确。选项C中应该用环形玻璃搅拌棒,不正确,草酸晶体加热时,能生成液体,所以选项D正确,答案选D。
本题难度:一般
2、填空题 (12分)
KClO3在农业上用作除草剂,超细CaCO3泛用于消光纸、无炭复写纸等。某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
I.
①电石与水反应的化学方程式是__________。
②残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成池液,通人Cl2,得到Ca(Clo3)2与Cacl2物质的量之比为1:5的溶液,反应的化学方程式是________________
III.向II所得溶液中加人KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。你认为能得到KClO3晶体的原因是________________。
IV.将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、C02,便可获得超细CaCO3,过程如下:
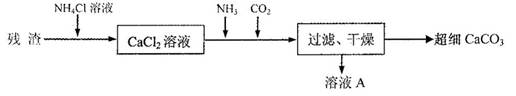
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是________
参考答案:(12分)

本题解析:略
本题难度:一般
3、实验题 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因___________________________________________。
(2)装置C的作用是____________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①________;②________。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
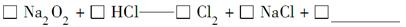
该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是____________________________________________(要求答出要点)。
参考答案:(1)Cl2 4H++4I-+O2=2I2+2H2O(或4I-+O2+2H2O=2I2+4OH-)
(2)吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气
(3)①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2
②O2有可能是Na2O2与盐酸中的H2O反应生成的
(4) 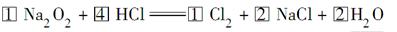
不能 实验室没有可直接使用的干燥HCl气体的物质;固体与气体反应较慢;产生的氯气中含有大量的氯化氢气体(答出任何一点即可,其他合理答案均可)
本题解析:(4)选择Na2O2、Cl2配平,Na2O2中氧的化合价降低2价、生成氯气化合价升高2价,所以Na2O2、Cl2的化学计量数均为1,再配NaCl的化学计量数为2。
本题难度:一般
4、填空题 如图所示的装置测定空气中氧气的含量。将燃烧匙中的红磷点燃
迅速伸入钟罩中并塞上橡胶塞。
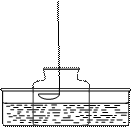
(1)?红磷燃烧的主要现象是?
写出反应的文字表达式为?
(2)实验结束后拔开胶塞,迅速伸入一燃着的细木条,可能发生的现象是??
(3)若实验结果测得氧气的含量不足21%,分析造成这种结果的原因可能有
①??
②??
参考答案:①?产生大量白烟?磷+氧气  ?五氧化二磷?
?五氧化二磷?
②?木条熄灭
③?装置漏气 ?红磷量不足
本题解析:略
本题难度:简单
5、简答题 实验室用图的装置将CO2和CO进行分离和干燥,已知a、b均为活塞,试回答:
(1)甲瓶中装的是______溶液,乙瓶中装的是______溶液,分液漏斗中装的是______;
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是______,活塞操作是______;然后得到______,活塞操作是______.?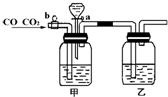
参考答案:(1)CO2是酸性氧化物,可用碱来吸收使其生成碳酸盐,碳酸盐遇酸可放出CO2,所以甲中装有NaOH溶液,用来吸收CO2,此时从乙中出来的是被乙中浓硫酸干燥过的纯净的CO,因为该题中要求分离CO和CO2,所以最终还要求把甲中吸收的CO2再放出来,所以分液漏斗中装稀硫酸,用来生成CO2;
(2)实验的具体操作为:首先打开b,使混合气体通过甲中浓NaOH溶液,CO2被浓NaOH吸收生成Na2CO3,CO则通过甲进入乙,干燥之后收集CO,然后关闭b,去掉分液漏斗的塞子,打开a,漏斗中的稀硫酸与甲中生成物Na2CO3反应放出CO2,经乙干燥,再收集CO2.
故答案为:
(1)NaOH,浓H2SO4,稀H2SO4;
(2)CO;打开b,关闭a,CO2,打开a,关闭b.
本题解析:
本题难度:一般