微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
(1)已知短周期元素A、B原子的第一至第四电离能如下表所示:
电离能(kJ/mol)
| I1
| I2
| I3
| I4
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
|
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______。

②ACl2分子中A的杂化类型为__________,ACl2空间构型为__________。
(2)已知C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱。D是周期表中电负性最大的元素。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物。请根据上述信息。
①写出E元素原子基态时的电子排布式____________________。
②以C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为__________。
③D与Ca2+可形成离子化合物,其晶胞结构如图所示。其中Ca2+离子的配位数为__________,若该晶体的密度为ag/cm3,则该晶胞的体积是__________cm3(写出表达式即可)。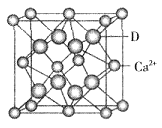
参考答案:(1)①能量最低原理(2分)?②sp(2分)?直线(2分)
(2)①1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)
②Al-3e-+4OH-=AlO2-+2H2O(2分)?③8; ?(3分)
?(3分)
本题解析:(1)A的第三电离能比第二电离能大很多,这说明A很难失去3个电子,因此A应该是第ⅡA族元素。同样B的第三电离能比第二电离能大很多,即B也很难失去3个电子,因此B是第ⅡA族元素。?同主族自上而下金属性逐渐增强,第一电离能逐渐减小,则A是Be,B是Mg。
①根据核外电子排布规律可知,只有排满了3s才能排3p,所以该示意图违背了能量最低原理。
②BeCl2分子中Be含有的孤电子对数是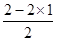 ?=0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。
?=0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。
(2)C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱,因此C是铝。D是周期表中电负性最大的元素,则D是F。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E是Cu。
①根据核外电子排布规律可知铜元素原子基态时的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
②以C单质、镁、NaOH溶液可以构成原电池,由于铝能与氢氧化钠溶液反应,而镁不能,因此负极是铝,镁是正极,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O。
③根据晶胞结构可知,钙离子周围与钙离子最近的氟离子有8个(每个面被2个立方体共用),则Ca2+离子的配位数为8。晶胞中含有该离子的个数是8×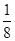 ?+6×
?+6× ?=4,氟离子是8个,因此
?=4,氟离子是8个,因此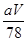 ?×6.02×1023=4,解得V=
?×6.02×1023=4,解得V=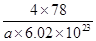 ?cm3。
?cm3。
本题难度:一般
2、选择题 分析下列各物质的物理性质,可判断其固态不属于分子晶体的是( ? )
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B.溴化铝,无色晶体,熔点98℃,熔融态不导电
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中
D.氯化铝,无色晶体,熔融时不能导电
参考答案:A
本题解析:分子晶体的熔沸点比较底,熔融时是不能导电的,所以选项A不是分子晶体,而是原子晶体。答案选A。
本题难度:一般
3、填空题 某同学为了研究晶体的性质做如下的实验:
①在一烧杯中加入一定量的水,加入硫酸铜固体配成饱和溶液;
②再加入一定量的硫酸铜;
③取一小的硫酸铜晶体,去除晶体的一小角;
④用头发系住晶体,把另一头系在一玻璃棒上, 并悬在烧杯口,晶体浸没在溶液中;
⑤过一夜后,取出发现小晶体长大并变得非常规则。
请回答下列问题:
(1)为什么要加过量的硫酸铜?如果不过量,现象又如何?________________________
(2)小晶体长大、变得更规则说明什么?________________________
参考答案:(1)加过量的硫酸铜是使晶体长大,晶体的大小不变,但是变得外形很规则
(2)说明晶体的规则几何外形、晶体的各向异性
本题解析:
本题难度:一般
4、填空题 (12分)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式?;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是?。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式?。
(2)测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5:?;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。?
(3)已知硫酸铜品体受热可以逐步失去结品水,温 度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为?;在1200℃并恒温1小时,反应所 得气态产物除去水后,物质的量为?。(填字母)
得气态产物除去水后,物质的量为?。(填字母)
A.0 mol
B.0.1mol
C.0.125mol
D.大于0.125mol
参考答案:(12分,每空2分)
(1)①3Fe2O3+CO
CO太多导致Fe3O4还原为铁,CO太少Fe2O3没有全部转化成Fe3O4
②CaCl2+SiO2+H2O
(2)将步骤4中的坩埚再加热一定时间,放入干燥器中冷却至室温后称越。重复本操作,直至两次称量结果不变;
(3)CuSO4·3H2O,D
本题解析:略
本题难度:简单
5、选择题 AB、CD、EF均为1∶1型离子化合物,根据下列数据判断它们的熔点由高到低的顺序是
物质
| AB
| CD
| EF
|
离子电荷数
| 1
| 1
| 2
|
键长(10-10 m)
| 2.31
| 3.18
| 2.10
|
A.CD>AB>EF? B.AB>EF>CD
C.AB>CD>EF? D.EF>AB>CD
参考答案:D
本题解析:离子晶体熔点的高低与阴阳离子所带电荷及离子键键长有关,电荷越多,键长越短,离子键越强,熔点越高。
本题难度:简单