微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电子式书写错误的是(?)
A.甲基:
B.NH4+: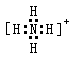
C.CO2: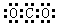
D.H-:
参考答案:C
本题解析:CO2中碳和氧形成的是双键,所以正确的电子式为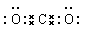 ,C是错误的。其余选项均正确。答案选C。
,C是错误的。其余选项均正确。答案选C。
本题难度:一般
2、填空题 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
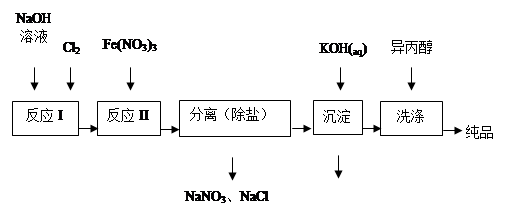 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法
| 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
|
干法
| Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
|
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
参考答案:(共15分,除(1)③3分外其它每空2分)
(1)①减少高铁酸钾的溶解损失(2分)
②2NaOH+Cl2=NaCl+NaClO+H2O(2分)
③3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O(3分)
④3(2分)
(2)①增大K+浓度,促进K2FeO4晶体析出(2分) ②小(2分)
(3)3:1(2分)
本题解析:
(1)①钾盐易溶于水,用有机溶剂可以避免钾盐的损失
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠、和水。
③上一步反应生成了次氯酸根,作为唯一的氧化剂氧化三价铁离子生成氯离子和高铁酸盐。
④Ksp〔Fe(OH)3〕=c3(OH-)·c(Fe3+)算出,c(OH-)=10-11,根据pH的算法,pH=3.
(2)①Ksp〔K2FeO4〕=c2(K+)·c(FeO42-),故增加钾离子浓度可以析出K2FeO4晶体。
②否则就用同样类似的方法制备Na2FeO4了。
(3)N得到2个电子,Fe 得到3个电子,所以N*3,Fe *2,又因为是Fe2O3(重点是Fe2),故比例为3:1.
考点:考查氧化还原反应,以及非金属单质及其化合物,化学反应原理等。
本题难度:困难
3、填空题 (12分)已知钙的金属活泼性介于钾和钠之间,其化学性质与钠相似。钙及其化合物的有关反应如下:
①Ca+2H2O Ca(OH)2+H2↑ ②CaO+H2O
Ca(OH)2+H2↑ ②CaO+H2O Ca(OH)2
Ca(OH)2
③CaO2+H2O ④CaO+CO2
④CaO+CO2 CaCO3
CaCO3
⑤2CaO2+2CO2 2CaCO3+O2
2CaCO3+O2
结合所学知识完成下列问题:
(1)完成上述③的化学方程式: CaO2 + H2O ;
;
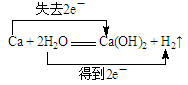
(2)用双线桥标出反应①的电子转移方向和数目:Ca+2H2O Ca(OH)2+H2↑
Ca(OH)2+H2↑
(3)写出以钙为原料制取过氧化钙(CaO2)的化学方程式: ;
(4)在CaO2的水溶液中,滴入酚酞溶液,预期的实验现象可能是 ;在该溶液中加入少量的MnO2固体,有气泡生成,写出该反应的化学方程式 。
参考答案:
(1)2CaO2 + 2H2O 2Ca(OH)2+O2↑(2分)(2)
2Ca(OH)2+O2↑(2分)(2) (4分)
(4分)
(3)Ca+O2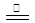 CaO2(2分)(4)溶液先变红色,后褪色(2分);2H2O2
CaO2(2分)(4)溶液先变红色,后褪色(2分);2H2O2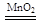 2H2O+O2↑(2分)。
2H2O+O2↑(2分)。
本题解析:(1)从信息可以看出CaO2的性质与Na2O2相似,根据2Na2O2+2H2O 4NaOH +O2↑推出CaO2和H2O的方程式为2CaO2 + 2H2O
4NaOH +O2↑推出CaO2和H2O的方程式为2CaO2 + 2H2O 2Ca(OH)2+O2↑(2)Ca从0价变为+2价,失去2个电子,H的化合价从+1价变为0价,得到1个电子,有2个H原子化合价发生了改变,用双线桥标出反应①的电子转移方向和数目如下:
2Ca(OH)2+O2↑(2)Ca从0价变为+2价,失去2个电子,H的化合价从+1价变为0价,得到1个电子,有2个H原子化合价发生了改变,用双线桥标出反应①的电子转移方向和数目如下:
(3)根据2Na+O2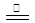 Na2O2知道以钙和O2在加热的条件下反应可以生成过CaO2,化学方程式为:Ca+O2
Na2O2知道以钙和O2在加热的条件下反应可以生成过CaO2,化学方程式为:Ca+O2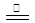 CaO2(4)根据CaO2和水反应的方程式知道有Ca(OH)2生成,溶液显碱性,加入酚酞溶液先变红色,CaO2也有强氧化性,所以溶液会褪色;CaO2与H2O反应的实质是先生成Ca(OH)2和H2O2,H2O2分解生成了O2,故加入MnO2固体会发生2H2O2
CaO2(4)根据CaO2和水反应的方程式知道有Ca(OH)2生成,溶液显碱性,加入酚酞溶液先变红色,CaO2也有强氧化性,所以溶液会褪色;CaO2与H2O反应的实质是先生成Ca(OH)2和H2O2,H2O2分解生成了O2,故加入MnO2固体会发生2H2O2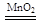 2H2O+O2↑反应。。
2H2O+O2↑反应。。
考点:利用类比法推断物质的性质,化学方程式的书写和氧化还原反应的电子转移的标注。
本题难度:一般
4、填空题 过量铁粉与稀硝酸反应的方程式为:
3Fe + 8HNO3 (稀)= 3Fe(NO3)2 + 2NO↑ + 4H2O
① 标出电子转移的方向和数目
② 该反应的氧化剂是 ,还原产物是 ;
③ 标准状况下,当生成2.24L NO气体时, 有 g Fe参加反应,转移的电子总数为个,有 mol氧化剂被还原。
参考答案:
① 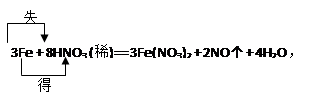
② HNO3,NO ③8.4,0.3NA,0.1
本题解析:反应中Fe由0价升为+2价,每3molFe反应,失6mole-。N由+5价降为+2价,每生成2molNO转移6mole-。还原剂是Fe、氧化剂是硝酸、氧化产物是硝酸亚铁、还原产物是NO。每生成1molNO,有1.5molFe反应,转移3mole-,有1molHNO3被还原。
考点:氧化还原反应
点评:氧化还原反应中,还原剂失电子、被氧化、生成氧化产物;氧化剂得电子、被还原、生成还原产物。
本题难度:一般
5、选择题 下列有关化学用语使用正确的是
A.NH4Br的电子式:
B.S2-的结构示意图: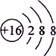
C.乙酸的分子式: CH3COOH
D.原子核内有l8个中子的氯原子: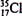
参考答案::BD
本题解析::书写电子式时,阴离子要标明最外层电子数且用中括号,A错;硫原子的电子层排布为:2、8、6,得到2个电子后,形成8电子稳定结构,B对;乙酸的分子式为C2H4O2,选项中给出的是其结构简式,C错;氯原子的核电荷数为17,含有18个中子的气质量数为35,D对。
【考点定位】此题从电子式、原子结构、分子式等角度考查了化学用语知识。
本题难度:一般