|
高考化学知识点总结《探究性实验的设计与评价》考点强化练习(2017年押题版)(十)
2017-08-06 10:23:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下:
 ? ? ? ? ? ?
A? B? ?C ?C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有?(从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL??(填仪器名称)定容配成100 mL稀橙汁。取洁净的 ?(从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入?中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是?溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视?。滴定至终点时的现象是? ?。 ?。
(4)重复上述实验。
(5)数据记录和处理:
实验次数
| 稀橙汁体积(mL)
| 滴定用标准碘(水)溶液(mL)
| 1
| 25.00
| 23.10
| 2
| 25.00
| 23.00
| 3
| 25.00
| 22.90
|
?从实验数据可知,该橙汁饮料中维生素C的含量为??mg·L-1
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果??(选填“偏高”或“偏低”或“无影响”)
参考答案:(1)A 。
(2)?容量瓶;? A ;? C;?淀粉。
(3)锥形瓶中溶液颜色变化和标准碘溶液滴速。?
锥形瓶中溶液刚由橙(黄)色变为(淡)蓝色且半分钟不变色。
(5)? 121.44。?
(6) 偏低。
本题解析:略
本题难度:一般
2、实验题 (12分)某学生实验兴趣小组拟用图1装置来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验。
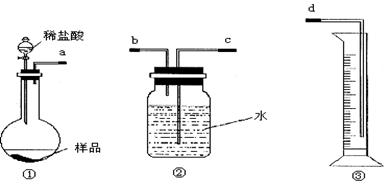
图1
(1)各仪器接口连接顺序是_________________(用接口字母填写)。
(2)该装置连接好而未装药品前,检验气密性的操作是_________________________。
(3)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有______。(填序号)
A.在滴入盐酸之前,应排净装置内的CO2气体
B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液
C.在装置②中水换成饱和Na2CO3溶液
D.滴加盐酸不宜过快
| (4)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置。假定滴定管起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为_______。
(用含V1、V2、V3、m的式子表示)。
 ? ?
(5)丙同学改用图3装置,通过测定烧杯的质量。你认为乙、丙两同学的方案中,谁的方案更合理__________,理由是:_____________。
参考答案:(1)a、b、c、d(2分)
(2)答案1:在②中加水浸没长导管,关闭分液漏斗活塞,用手握住圆底烧瓶(或酒精灯微热),若②中长导管内液面上升,则说明气密性好;答案2:在③中加水浸没导管,关闭分液漏斗活塞,用酒精灯微热,若③中导管口产生均匀的气泡,停止加热后,导管末端形成一段水柱且保持一段时间不下降,则说明气密性好。(2分)
(3)BD(2分)
(4)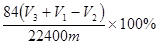 (2分) (2分)
(5)乙同学(1分)丙同学的方案中,生成的CO2没有全被NaOH溶液吸收。(2分)
本题解析:(1)根据实验装置图可知,是利用通过排水法测量水的体积,进而得出气体的体积,实验正确的顺序是a、b、c、d。
(2)根据装置的特点可知,检验方法是在②中加水浸没长导管,关闭分液漏斗活塞,用手握住圆底烧瓶(或酒精灯微热),若②中长导管内液面上升,则说明气密性好;或在③中加水浸没导管,关闭分液漏斗活塞,用酒精灯微热,若③中导管口产生均匀的气泡,停止加热后,导管末端形成一段水柱且保持一段时间不下降,则说明气密性好。
(3)由于反应后装置中会残留部分CO2气体,所以反应前没有必要排净装置内的CO2气体。由于CO2能和碳酸钠溶液反应,所以C也不正确,因此正确的答案是BD。
(4)根据体积的变化可知,生成的CO2是V3-(V2-V1)=V3+V1-V2,其物质的量是(V3+V1-V2)/22400mol,所以碳酸氢钠的质量是84(V3+V1-V2)/22400g,因此质量分数是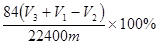 。 。
(3)根装置③的结构可知,反应中产生的CO2不可能完全被氢氧化钠溶液吸收,测定结果偏低,所以不如装置②好。
本题难度:一般
3、实验题 (13分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】用葡萄糖制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:?。甲同学还发现用同浓度FeCl3,Fe(NO3)3溶解银镜,FeC l3溶液溶解Ag的反应更快更完全,请解释其原因: l3溶液溶解Ag的反应更快更完全,请解释其原因:
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
实验步骤(不要求写具体操作过程)
| 预期现象和结论
| ①
②
……
| 若银镜消失,假设2成立。
若银镜不消失,假设2不成立。
|
【思考与交流】
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你是否同意丙同学的结论?,并简述理由:?。
参考答案:(1)Fe3++Ag= Fe2++Ag+(2分)? FeCl3中Cl-与Ag+生成AgCl,促进正向反应完全。(2分)
(2)①测定上述实验用的Fe(NO3)3溶液的pH;(2分)
本题解析:略
本题难度:简单
4、实验题 (17分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
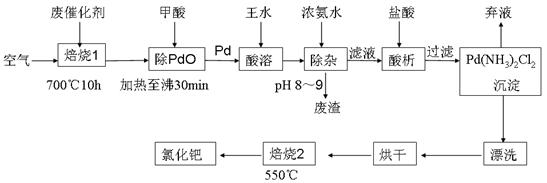
(1)甲酸还原氧化钯的化学方程式为 ?。
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式)。
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为 ?
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
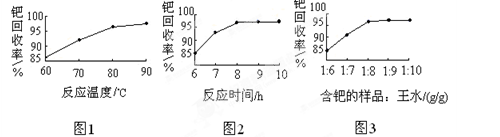
(4)钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯的适宜条件是:反应温度为 ?,反应时间约为 ?,含钯的样品与王水的质量比为 ?。
(5)700℃“焙烧1”的目的是 ?, 550℃“焙烧2”的目的是 ?。
参考答案:(1)PdO+HCOOH Pd+CO2↑+H2O;(2)Fe(OH)3;(3)①NO;②H2PdCl4;(4)80~90℃;8h;1:8;(5)除去活性炭及有机物,脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”] Pd+CO2↑+H2O;(2)Fe(OH)3;(3)①NO;②H2PdCl4;(4)80~90℃;8h;1:8;(5)除去活性炭及有机物,脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”]
本题解析:(1)甲酸 分子中含有醛基,有还原性,能把氧化钯还原为Pd,它本身被氧化为碳酸,反应的化学方程式为PdO+HCOOH 分子中含有醛基,有还原性,能把氧化钯还原为Pd,它本身被氧化为碳酸,反应的化学方程式为PdO+HCOOH Pd+CO2↑+H2O;(2)王水有强的氧化性,会把Fe氧化为Fe3+,加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素也会形成Fe(OH)3沉淀。(3)①王水把Pb氧化时,其中的硝酸被还原得到无色、有毒的气体B是NO;②Pd:42.4÷106.4=0.4;H:0.8÷1=0.8.所以Pd:H=1:2.由于Pd是+2价,H为+1价,根据化合物的正负化合价的代数和为O,所以还应该含有4个-1价的阴离子。它的物质的量为0.4mol×4=1.6mol.因此其相对原子质量为:(1-42.4%-0.8%)÷(0.4×4)=35.5。所以该离子是Cl-。A的化学式为H2PdCl4;(4)由题目提供的示意图可知则王水溶解钯的适宜的反应温度为80~90℃;反应时间约为8小时,含钯的样品与王水的质量比为1:8。(5)700℃“焙烧1”的目的是除去废Pd催化剂中的活性炭及有机物杂质;550℃“焙烧2”的目的是将Pd(NH3)2Cl2煅烧使之转变为PdCl2。2)的反应原理、反应条件的选择、化学式的确定、方程式的书写。 Pd+CO2↑+H2O;(2)王水有强的氧化性,会把Fe氧化为Fe3+,加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素也会形成Fe(OH)3沉淀。(3)①王水把Pb氧化时,其中的硝酸被还原得到无色、有毒的气体B是NO;②Pd:42.4÷106.4=0.4;H:0.8÷1=0.8.所以Pd:H=1:2.由于Pd是+2价,H为+1价,根据化合物的正负化合价的代数和为O,所以还应该含有4个-1价的阴离子。它的物质的量为0.4mol×4=1.6mol.因此其相对原子质量为:(1-42.4%-0.8%)÷(0.4×4)=35.5。所以该离子是Cl-。A的化学式为H2PdCl4;(4)由题目提供的示意图可知则王水溶解钯的适宜的反应温度为80~90℃;反应时间约为8小时,含钯的样品与王水的质量比为1:8。(5)700℃“焙烧1”的目的是除去废Pd催化剂中的活性炭及有机物杂质;550℃“焙烧2”的目的是将Pd(NH3)2Cl2煅烧使之转变为PdCl2。2)的反应原理、反应条件的选择、化学式的确定、方程式的书写。
本题难度:一般
5、实验题 ( 12分 ) ( 1 ) 在试管里加入2 mL蛋白质溶液,然后加入2 mL甲醛溶液,可以看_____,把少量沉淀放入盛有蒸馏水的试管里,沉淀 __________ 。
( 2 ) 1995年美国科学家Lagow报道,他制得了碳的第四种同素异形体——链式炔碳。…—C≡C—C≡C—C≡C—C≡C—…有300~500个碳原子,该物质很活泼。回答下列问题:
①链式炔碳的熔点,估计比石墨 ________ ( 填“高”或“低” ) 。
②推测链式炔碳C300经适当处理可得含多个C≡C的链状化合物C300H296,该分子中含C≡C最多可达个 ________ 。
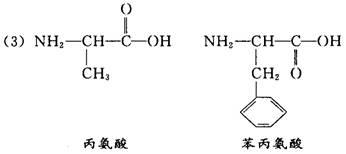
( 3 ) 高分子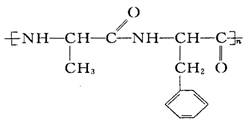 水解产物的分子结构简式和名称分别是 __________________ ,______________________ 。 水解产物的分子结构简式和名称分别是 __________________ ,______________________ 。
参考答案:( 1 ) 有沉淀产生 不溶解
( 2 ) 低 76
本题解析:( 1 ) 考查蛋白质的性质,在加热、紫外线、X射线、强酸、强碱、重金属、甲醛、酒精、苯甲酸存在下变性,丧失了原有的性质。
( 2 ) 链式炔碳为分子晶体,熔沸点较低与烷烃 C300H602相比,氢原子数相差306,多一个C≡C少4个氢原子,所以应有76个C≡C。
本题难度:简单
|  ?
?