|
高考化学必考知识点《盐类水解的原理》高频试题强化练习(2017年最新版)(八)
2017-08-06 10:24:25
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是
A.②④
B.③④
C.②⑤
D.①⑤
|
参考答案:A
本题解析:当氨水与盐酸恰好完全反应时,生成NH4Cl和水,由于水解反应使溶液呈酸性,当将氨水滴入盐酸中至中性,说明氨水过量,①③错误,②正确;由电荷守恒得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),溶液呈中性说明c(H+)=c(OH-),则c(NH4+)=c(Cl-),④正确,选A.
考点:考查水的电离和溶液的酸碱性,盐的水解等知识。
本题难度:一般
2、填空题 (11分)按要求回答下列问题
(1)K HSO4溶液显 __性(填“酸” “碱” 或“中性”),其原因是(用电离方程式表示) HSO4溶液显 __性(填“酸” “碱” 或“中性”),其原因是(用电离方程式表示)  ; ;
(2) KHCO3溶液显 _性(填“酸” “碱” 或“中性”),其原因是(用离子方程式表示)  ; ;
(3) 将上述两溶液混合,离子反应方程 式为 。 式为 。
(4)在Na2CO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是________________,其原因是(以离子方程式和简要文字说明) ___________________________________。
参考答案:(11分)
(1)酸(1分) KHSO4=K++H++SO42-(2分)
(2)碱 (1分) HCO3- + H2O (1分) HCO3- + H2O  H2CO3 + OH-(2分) H2CO3 + OH-(2分)
(3) HCO3- +H+ =CO2↑ +H2O HCO3- +H+ =CO2↑ +H2O (2分) (2分)
 (4)溶液褪色或变浅(1分) (4)溶液褪色或变浅(1分)
Ba2+ + CO32- =BaCO3↓ 生 成 成 难溶BaCO3,使溶液水解碱性减弱(2分) 难溶BaCO3,使溶液水解碱性减弱(2分)
本题解析:略
本题难度:一般
3、选择题 结构简式为
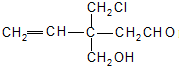
的有机物,不能发生的反应是( )
A.消去反应
B.加成反应
C.酯化反应
D.银镜反应
参考答案:A
本题解析:
本题难度:简单
4、选择题 常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合前的醋酸约1%发生电离
B.混合后的溶液中c(Na+)=c(CH3COO-)
C.氢氧化钠和醋酸的浓度不相等
D.混合后的溶液呈中性
参考答案:A
本题解析:试题分析:A、醋酸是弱酸,存在电离平衡,pH=4的醋酸溶液中氢离子浓度是10-4mol/L。常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,这说明醋酸浓度等于强碱氢氧化钠的浓度,即醋酸的浓度是10-4mol/L,所以混合前的醋酸约有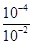 ×100%=1%发生电离,A正确;B、恰好反应时生成醋酸钠,CH3COO-水解,溶液显碱性,因此根据电荷守恒可知,溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不正确;C、氢氧化钠和醋酸的浓度相等,都是10-2mol/L,C不正确;D、混合后的溶液呈碱性,D不正确,答案选A。 ×100%=1%发生电离,A正确;B、恰好反应时生成醋酸钠,CH3COO-水解,溶液显碱性,因此根据电荷守恒可知,溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不正确;C、氢氧化钠和醋酸的浓度相等,都是10-2mol/L,C不正确;D、混合后的溶液呈碱性,D不正确,答案选A。
考点:考查醋酸与氢氧化钠溶液中和后溶液酸碱性判断以及离子浓度大小比较
本题难度:困难
5、选择题 0.1 mol·L-1的某溶液的pH=5.1,此溶液可能是
①NaCl
②CH3COONa
③HCl
④NH4Cl
A.①②
B.③④
C.②③
D.④
参考答案:D
本题解析:pH=5.1溶液为酸性,若为③其0.1 mol·L-1的溶液pH=1,因此只能是水解显酸性的强酸弱碱盐NH4Cl溶液.CH3COONa水解显碱性.
本题难度:困难
|