微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
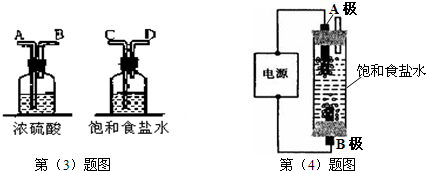
1、选择题 某学生欲完成2HCl?+?2Ag?=?2AgCl?+?H2↑的反应,设计了如图所示的四个实验,你认为可行的实验是?
[? ]
A.
B.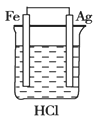
C.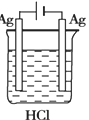
D.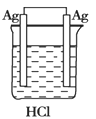
参考答案:C
本题解析:
本题难度:一般
2、简答题 实验室常用二氧化锰和浓盐酸共热的方法制取氯气,根据要求回答下列问题.
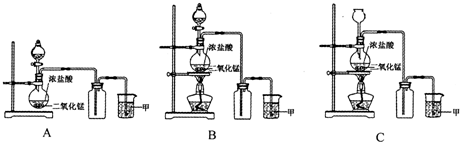
(1)A、B、C三套装置中,应选用的装置是______(选填“A”、“B”、“C”);
(2)为了防止氯气污染环境,图中所示的溶液甲为______.
(3)要制得纯净干燥的氯气,需要在气体发生装置和收集装置间增加净化装置,请将下面提供仪器的导管接口按次序连接:
气体发生装置→______→______→______→______→收集装置.(用字母表示)
(4)工业上用电解饱和食盐水的方法制备氯气,写出其化学反应原理,并用“双线桥法”标出电子转移的方向和数目______.有人用上图所示装置制取消毒液(主要成分为NaClO),则A极应该接电源的______极(填正、负).
参考答案:(1)实验室用二氧化锰和浓盐酸共热的方法制取氯气,A缺少加热装置,HCl易挥发,不能用长颈漏斗,应用分液漏斗,只有B符合,故答案为:B;
(2)氯气有毒,不能排放到空气中,氯气与碱反应,可用NaOH溶液吸收,故答案为:NaOH溶液;
(3)要制得纯净干燥的氯气,应先将混合气体通过盛有饱和NaCl溶液的洗气瓶,除去HCl气体,再通过浓硫酸干燥,气体通过洗气瓶时,气体要长进短出,所以,连接顺序为,发生装置→C→D→A→B→收集装置,
故答案为:发生装置→C→D→A→B→收集装置;
(4)反应在通电条件下生成氢气和氯气,反应中,Cl元素的化合价有-1价升高到0价,每生成1个氯气分子失去2个电子,H元素的化合价由+1价降低到0价,每生成1个氢气分子得到2个电子,用图中装置制备消毒液,氯气应在B极上生成,才能充分与A极生成的NaOH充分反应生成NaClO,所以A极为阴极,连接电源的负极,
故答案为:
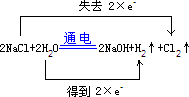
;负.
本题解析:
本题难度:一般
3、选择题 某水溶液中含有等物质的量的Cu2+、Cl-、H+、SO42-,该溶液放在电解槽中,下列说法正确的是
[? ]
A.用石墨做电极时,首先在阴极放电的是Cl-
B.用石墨做电极时,电解一段时间后H+有可能在阴极放电
C.用铁做电极时,阳极反应式:2Cl--2e-=Cl2↑
D.用石墨做电极时,开始电解时Cl-与H+首先放电
参考答案:B
本题解析:
本题难度:一般
4、简答题 工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图.
(1)这种阳离子交换膜,只允许溶液中的______通过.(填下列微粒的编号)
①H2②Cl2③H+④Cl-⑤Na+⑥OH-
(2)写出在电解过程中阳极发生的电极方程式:______.
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通.则理论上计算,电解后流出的氢氧化钠溶液的质量分数为______.
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.回答下列问题:
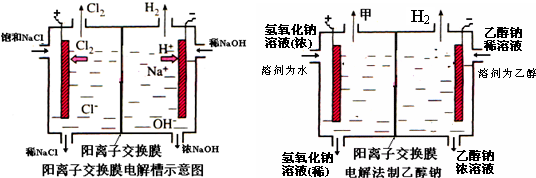
①写出在电解过程中阴极发生的电极方程式______.
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:______.
参考答案:(1)阳离子交换膜只允许阳离子钠离子、氢离子通过,而阴离子和分子均不能通过,故答案为:③⑤;
(2)电解池中和电源的正极相连的是电解池的阳极,阳极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(3)氢气的质量=VVmM=896L22.4L/mol×2g/mol=80g;电解水时,生成氢气与氢氧化钠的物质的量之比为1:2,所以生成氢氧化钠的质量=2896L22.4L/mol×40g/mol=3200g,溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×896L22.4L/mol×23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,
电解后流出的氢氧化钠溶液的质量分数=4200g11760g×100%=35.7%,
故答案为:35.7%;
(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+2e-=2CH3CH2O-+H2↑.
故答案为:2CH3H2OH+2e-=2CH3CH2O-+H2↑;
?②从溶液中析出溶质的方法是蒸发结晶,故答案为:蒸发结晶.
本题解析:
本题难度:一般
5、填空题 (14分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
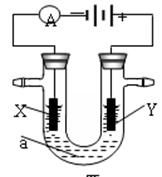
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将 (填“变大”、“变小”或“不变”)
参考答案:(1)①2 H+ +2e- =H2 ↑ ②2 Cl--2e- =Cl2 ↑
(2)①粗铜, Cu -2 e- = Cu2+ ②纯铜, Cu2+ +2 e- =Cu 变小
本题解析:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:2H++2e-=H2↑;放出气体,溶液变红;②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑。故答案为:2Cl--2e-=Cl2↑;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:纯铜; Cu2++2e-=Cu;②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜,Cu-2e-=Cu2+ CuSO4溶液的浓度将变小
考点:原电池和电解池的工作原理
本题难度:一般