| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《电解池原理》高频试题强化练习(2017年最新版)(十)
参考答案:C 本题解析:A.将0.2mol/L的NH3·H2O与0.1mol/L的HCl溶液等体积混合后生成氯化铵,其中氨水过量,且二者的浓度相等。溶液的pH >7,说明氨水的电离程度大于铵根的水解程度,则c(NH4+)>c(Cl-)>c(OH-)>c(H+),A错误;B.已知MgCO3的Ksp=6.82×10-6,但所有含有固体MgCO3的溶液中,不一定有C(Mg2+)=C(CO32-),且c(Mg2+)·c(CO32-)==6.82×10-6 mol?L—1,B错误;C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合后根据物料守恒可知: 本题难度:一般 4、选择题 碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是 |
参考答案:D
本题解析:A、根据装置图可知A是原电池,B是电解池,VB2电极发生氧化反应,失去电子与氢氧根离子结合生成水,碱性溶液中不会产生大量的氢离子,错误;B、a电极是正极,则b电极是阳极,c电极是阴极,则外电路中电子从VB2极流出流向c电极,再从b电极流出,流向a电极,错误;C、电解过程中,铜离子应在阴极析出,即c电极析出红色Cu单质,b电极产生气泡,错误;D、当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体,因为阳极只有氢氧根离子放电生成氧气,通过0.04mol电子,生成氧气的物质的量是0.01mol,标准状况下的体积是0.224L,所以阴极还产生0.224L的氢气,则阴极是铜离子和氢离子放电,产生0.224L氢气转移的电子物质的量是0.02mol,所以铜离子得到电子的物质的量是0.04-0.02=0.02mol,铜离子的物质的量是0.01mol,则硫酸铜溶液的浓度是0.01mol/0.2 L=0.05mol/L,正确,答案选D。
考点:考查电化学反应原理的应用
本题难度:一般
5、填空题 如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极,请回答下列问题: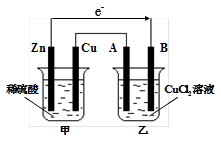
(1)Zn电极为 极,B电极上的产物是 (写化学式)
(2)写出乙装置中发生反应的化学方程式
参考答案:(1)负 Cu (2)CuCl2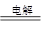 Cu+Cl2↑
Cu+Cl2↑
本题解析:(1)锌比铜活泼,且锌能和稀硫酸反应,所以甲装置是原电池,乙装置是电解池。其中锌是负极,B电极是阴极,溶液中的铜离子在阴极放电,生成单质铜。
(2)惰性电极电解氯化铜溶液的方程式是CuCl2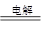 Cu+Cl2↑。
Cu+Cl2↑。
考点:考查原电池、电解池的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查。试题紧扣教材,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《燃烧热》在.. | |