微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下将amol PCl5充入一容积固定密闭容器中达到如下平衡:PCl5(g) PCl3(g)+Cl2(g),此时压强为P1;再向容器中通入amol PCl5,在同温下又达到平衡时的压强为P2,则下列说法中正确的是?(?)
PCl3(g)+Cl2(g),此时压强为P1;再向容器中通入amol PCl5,在同温下又达到平衡时的压强为P2,则下列说法中正确的是?(?)
A? 2P1>P2?B? 2P1=P2?C? 2P1<P2?D? P1=P2?
参考答案:A
本题解析:平衡后再向容器中通入amol PCl5时,相当于将压强为P1时的2个平衡混合在一起,此时瞬间的压强为2 P1,因为增大压强,平衡向体积减小的逆反应方向移动,所以再次平衡后的压强应该小于2 P1,即选项A正确。
本题难度:简单
2、选择题 已知反应:3A+4B=C+2D其反应速率可以分别用V(A)、V(B)、V(C)、V(D)[mol/(L?min)]表示,则正确的关系是( )
A.V(A)=
V(C)
B.V(B)=V(A)
C.V(C)=4V(B)
D.V(D)=V(C)
参考答案:各物质的化学反应速率与其在反应方程式中的化学计量数成正比,
A、反应物A的计算量为3,C的计量数为1,所以V(A)=3V(C),故A错误;
B、反应物B的化学计量数为4,A的化学计量数为3,所以V(B)=43V(A),故B正确;
C、生成物C的化学计量数为1,B的计量数为4,则V(C)=14V(B),故C错误;
D、生成物D的化学计量数为2,C的计量数为1,则V(D)=2V(C),故D错误;
故选B.
本题解析:
本题难度:简单
3、实验题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
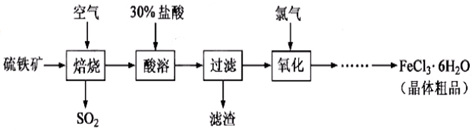
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为K= ??;过量的SO2与NaOH溶液反应的化学方程式为?
2SO3(g) ,该反应的平衡常数表达式为K= ??;过量的SO2与NaOH溶液反应的化学方程式为?
(2)酸溶及后续过程中均需保持盐酸过量,其目的是?、??。
(3)通氯气氧化后时,发生的主要反应的离子方程式为??;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 ?(写化学式)。
参考答案:(1)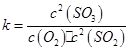 ? SO2+NaOH=NaHSO3;
? SO2+NaOH=NaHSO3;
(2)提高铁元素的浸出率?抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+? Cl2? HCl
本题解析:(1)根据化学平衡常数概念写出平衡常数表达式;在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为
2SO3(g) ,该反应的平衡常数表达式为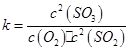 ;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程为载体考查平衡常数表达式的书写、物质的分离和提纯。
;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程为载体考查平衡常数表达式的书写、物质的分离和提纯。
本题难度:一般
4、选择题 已知常温下,N2(g)和H2(g)生成2molNH3(g)放出92.4kJ热量.现有甲、乙两个容积相同的密闭容器,在常温下:
①向密闭容器甲中通入1molN2和3molH2,达到平衡时放出热量Q1kJ.
②向密闭容器乙中通入0.5molN2和1.5molH2,达到平衡时放出热量Q2kJ.
则下列关系式正确的是( )
A.92.4>Ql>2Q2
B.92.4=Q1<2Q2
C.Q1=2Q2=92.4
D.Q1=2Q2<92.4
参考答案:①向密闭容器甲中通入1mol N2和3mol H2,达到平衡时,氢气和氮气不能完全转化;达到平衡时放出热量Q1kJ小于92.4KJ;
②假定0.5mol N2和1.5mol H2完全反应,达到平衡时放出热量Q2 kJ,根据N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1可知,放出的热量为:92.4kJ×0.5mol1mol=46.2kJ,由于合成氨是可逆反应,故反应物不能完全反应,所以放出的热量Q2小于46.2kJ;得到Q1>2Q2;综上所述可知:92.4>Ql>2Q2 ;
故选:A.
本题解析:
本题难度:简单
5、填空题 将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  ?2NH3(g)+CO2(g)
?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压
强/kPa
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度/mol·
L-1
| 2.4×
10-3
| 3.4×
10-3
| 4.8×
10-3
| 6.8×
10-3
| 9.4×
10-3
|
?
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解反应平衡常数:_______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
参考答案:(1)BC
(2)K=c2(NH3)·c(CO2)=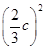 ·
·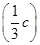 =
=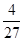 ×(4.8×10-3)3≈1.6×10-8
×(4.8×10-3)3≈1.6×10-8
(3)增加
本题解析:(1)A项不能表示正、逆反应速率相等;B项由于正反应方向气体分子数增大,则密闭容器中压强不变,反应达到平衡;C项恒容,若平衡发生移动,则混合气体密度发生改变;D项反应物是固体,NH3的体积分数始终为 。
。
(2)需将25 ℃的总浓度转化为NH3和CO2的浓度:
c(NH3)= ×4.8×10-3 mol·L-1=3.2×10-3 mol·L-1,c(CO2)=
×4.8×10-3 mol·L-1=3.2×10-3 mol·L-1,c(CO2)=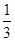 ×4.8×10-3 mol·L-1=1.6×10-3 mol·L-1,
×4.8×10-3 mol·L-1=1.6×10-3 mol·L-1,
K=(3.2×10-3)2×1.6×10-3≈1.6×10-8。
(3)增大压强,平衡向逆反应方向移动,固体质量增大。
本题难度:一般